Фон
SARS-CoV-2 был впервые идентифицирован после секвенирования соответствующих клинических образцов в группе неизвестных случаев вирусной пневмонии в декабре 2019 года в Ухане, провинция Хубэй, Китай. COVID-19, вызванный SARS-CoV-2, впоследствии был объявлен ВОЗ пандемией из-за его агрессивного широкомасштабного распространения во многих странах, что ежедневно приводит к тысячам подтвержденных случаев во всем мире. По состоянию на 15 ноября 2020 года во всем мире было зарегистрировано 53,7 миллиона подтвержденных случаев заболевания COVID-19 и 1,3 миллиона случаев смерти, что требует срочной необходимости раннего выявления тяжелых случаев.1 Клинические данные о SARS-CoV-2 позволяют предположить несколько путей передачи инфекции между людьми, причем основным источником инфекции, несомненно, являются респираторные аэрозольные капли. SARS-CoV-2 способен атаковать дыхательную систему, связываясь с рецепторами входа в клетки ACE2 на эпителиальных клетках дыхательных путей, и приводит к пневмонии и дыхательной недостаточности у пациентов в критическом состоянии.
Хронический бронхит, хроническая обструктивная болезнь легких (ХОБЛ) и астма являются распространенными респираторными заболеваниями с хроническим воспалением дыхательных путей.2–4 Эозинофилы, нейтрофилы и макрофаги при врожденном иммунном ответе значительно увеличиваются в дыхательных путях и легких во время начальной фазы воспаления. Сообщалось о лимфоцитопении у тяжелых пациентов, инфицированных SARS-CoV-2.5 Сообщалось также, что количество циркулирующих эозинофилов снижается у пациентов с COVID-19, что связано с тяжестью заболевания.6 Таким образом, пациенты с ХОБЛ, астмой и хроническим бронхитом могут иметь различные воспалительные состояния после заражения SARS-CoV-2 по сравнению с пациентами без хронического воспаления дыхательных путей.
В этом ретроспективном когортном исследовании мы рассмотрели медицинские карты 59 пациентов с лабораторно подтвержденным COVID-19 с хроническим воспалением дыхательных путей и сравнили демографические, клинические и радиологические характеристики, а также лабораторные результаты между тяжелыми и нетяжелыми пациентами в этой когорте. . Потенциальные предикторы тяжести заболевания были выявлены в аномальных лабораторных данных с использованием одномерных и многомерных регрессионных моделей.
Методы
Исследуемая совокупность и сбор данных
Субъектами этого исследования были взрослые с COVID-19 и сопутствующими хроническими респираторными заболеваниями (даты госпитализации с 26 января по 3 апреля 2020 г.) в китайско-французском отделении больницы Тунцзи в Новом городе. Тяжелые и нетяжелые пациенты были включены в основную и контрольную группы соответственно. COVID-19 был диагностирован в соответствии с временными рекомендациями ВОЗ.7 Больным с хроническими заболеваниями органов дыхания диагностировали согласно предшествующему диагнозу. У всех пациентов были подтверждены положительные результаты ПЦР с обратной транскриптазой на РНК SARS-CoV-2 в образцах мазков из зева. Исследование было проведено 15 июня. Демографическая информация, клинические характеристики (включая историю болезни, симптомы, сопутствующие заболевания, историю курения и историю аллергии) и радиологические результаты каждого пациента были получены из электронной системы медицинских записей китайско-французского отделения Нового города. больницы Тунцзи и проанализированы тремя независимыми исследователями. Степень тяжести COVID-19 определялась в соответствии с рекомендациями по диагностике и лечению COVID-19, опубликованными Национальным комитетом здравоохранения Китая (версии 5–7).
Критерии тяжести COVID-19
Тяжелая форма COVID-19 была диагностирована, когда пациенты соответствовали одному из следующих критериев: (1) респираторный дистресс с частотой дыхания ≥30 в минуту; (2) сатурация кислорода по пульсоксиметру ≤93% в покое; и (3) индекс оксигенации (парциальное давление кислорода в артерии/доля вдыхаемого кислорода) ≤300 мм рт. ст.
Лабораторные испытания
Результаты медицинских лабораторных исследований, включая количество лейкоцитов, лимфоцитов, моноцитов, эозинофилов, базофилов, тромбоцитов, аланинаминотрансферазы, аспартатаминотрансферазы, сывороточной креатинкиназы, сывороточной лактатдегидрогеназы (ЛДГ), азота мочевины крови, сывороточного креатинина, сердечного тропонина I, концентрации D. -димер, С-реактивный белок (СРБ), прокальцитонин, скорость оседания эритроцитов, сывороточный ферритин, цитокины (интерлейкин (IL) 2R, IL-6, IL-8, IL-10, фактор некроза опухоли (TNF)-α) и иммунные функции собирались по каждому пациенту из электронных медицинских карт.
статистический анализ
Все данные были проанализированы с помощью программного обеспечения SPSSStatistics (V.26). Статистические данные для категориальных переменных были суммированы в виде частот и процентов и сопоставлены с использованием χ2 тест или точный тест Фишера между различными группами, где это возможно. Непрерывные переменные описывали с использованием медианы (IQR) и сравнивали с помощью U-критерия Манна-Уитни. Для изучения факторов риска, связанных с тяжестью заболевания, использовались одновариантные и многовариантные модели логистической регрессии для оценки ОШ и 95% CI. Двустороннее α менее 0,05 считалось статистически значимым.
Полученные результаты
Демографические и клинические характеристики пациентов с нетяжелой и тяжелой формой COVID-19 с хроническими заболеваниями дыхательных путей
Всего поступило 1888 пациентов. У пятидесяти девяти пациентов с хроническим воспалением дыхательных путей, включая ХОБЛ (0,95%), астму (0,53%) и хронический бронхит (1,64%), было подтверждено наличие инфекции SARS-CoV-2. Из пациентов 33 были классифицированы как нетяжелые, а 26 - как тяжелые. Хотя ХОБЛ чаще встречалась у пациентов с тяжелой формой COVID-19 по сравнению с пациентами с нетяжелой формой COVID-19 (42% против 21%), разница не была статистически значимой.
Средний возраст всех пациентов составлял 71 год (IQR 57–80), и более половины (54%) были старше 70 лет. Большинство (71%) пациентов были мужского пола (Таблица 1). Существенной разницы по возрасту и полу между нетяжелыми и тяжелыми пациентами не было. Тридцать один (53%) пациент имел одно или несколько сопутствующих заболеваний, помимо трех хронических заболеваний дыхательных путей, причем наиболее распространенными сопутствующими заболеваниями были сердечно-сосудистые заболевания (46%) и заболевания эндокринной системы (15%). Существенных различий в наличии этих сопутствующих заболеваний между пациентами с нетяжелым и тяжелым течением COVID-19 не выявлено. Половина пациентов имели опыт курения или были курильщиками в настоящее время.
Демографические и клинические характеристики пациентов с COVID-19 с хроническим воспалением дыхательных путей при поступлении
Наиболее распространенными симптомами были лихорадка (83%), кашель (73%), утомляемость (47%) и одышка (42%). Одышка чаще встречалась у пациентов с тяжелым течением по сравнению с пациентами с нетяжелым течением (65% против 24%, p=0,001) (Таблица 1).
Лабораторные данные пациентов с нетяжелой и тяжелой формой COVID-19 с хроническими заболеваниями дыхательных путей
По сравнению с нетяжелыми пациентами, у тяжелых пациентов чаще наблюдалось повышенное количество нейтрофилов (8,2×10⁹/л против 4,1×10⁹/л, p=0,001), снижение количества лимфоцитов (0,6×10⁹/л против 1,1×10⁹/л). L, p<0,001), эозинопенения (<0,02×10⁹/л; 73% vs 24%, p<0,001), повышенный уровень D-димера (>1 мкг/мл; 88% vs 42%, p=0,001), повышение уровня ЛДГ (471,0 ЕД). /л vs 230,0 Ед/л, p<0,001), повышенный уровень азота мочевины крови (>9,5 ммоль/л; 42% vs 3%, p<0,001), повышение гиперчувствительности к тропонину I (>34 пг/мл; 48% vs 7%, p= 0,001) и повышение маркеров воспаления, включая СРБ (126,2 мг/л против 19,9 мг/л, p<0,001), прокальцитонин (≥0,05 нг/мл; 96% против 43%, p<0,001) и ферритин (1264,2 мг/л против 293,6). мг/л, р=0,004) (Таблица 2). Следует отметить, что между двумя группами наблюдались значительные различия в экспрессии цитокинов, связанных с воспалением, включая IL-6, IL-8 и TNF-α, которые резко увеличивались у тяжелых пациентов.
Лабораторные данные пациентов с COVID-19 с хроническим воспалением дыхательных путей при поступлении
Предикторы тяжести течения COVID-19 у пациентов с хроническими заболеваниями дыхательных путей
Чтобы выявить предикторы тяжести COVID-19 у пациентов с хроническими заболеваниями дыхательных путей, мы проанализировали связь между аномальными лабораторными показателями и тяжестью заболевания с помощью одномерных и многомерных моделей логистической регрессии. Тяжесть заболевания была в значительной степени связана со всеми вышеупомянутыми аномальными лабораторными результатами в одномерном логистическом регрессионном анализе. В многомерной регрессионной модели, которая включала лимфопению, эозинопению, повышенный уровень ЛДГ и повышенный уровень IL-6, количество эозинофилов <0,02×10⁹/л (ОШ на уменьшение на одну единицу, 10,115 (95% ДИ от 2,158 до 47,414), p=0,003) и ЛДГ уровень >225 Ед/л (ОШ на одну единицу увеличения, 22,300 (95% ДИ от 2,179 до 228,247), p=0,009) были независимыми факторами риска тяжести заболевания (таблица 3). Наши данные показывают, что снижение количества эозинофилов и повышение уровня ЛДГ могут помочь клиницистам идентифицировать тяжелую форму COVID-19 у пациентов с хроническими заболеваниями дыхательных путей.
Предикторы тяжести течения COVID-19 у пациентов с хроническими заболеваниями дыхательных путей
У нетяжелых пациентов количество эозинофилов и уровень ЛДГ имеют тенденцию со временем возвращаться к нормальному диапазону.
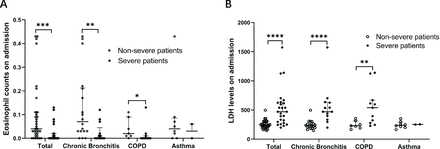
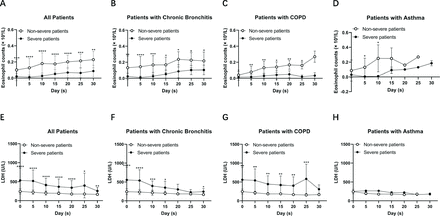
Далее мы проанализировали количество эозинофилов и уровни ЛДГ у пациентов с нетяжелым и тяжелым течением COVID-19 с хроническим бронхитом, ХОБЛ и астмой соответственно. Мы обнаружили, что существует значительная разница в количестве эозинофилов и уровнях ЛДГ между тяжелыми и нетяжелыми пациентами с хроническим бронхитом и ХОБЛ, но не у пациентов с астмой (Рисунок 1). Чтобы наблюдать динамические изменения количества эозинофилов и уровня ЛДГ с течением времени, мы собирали количество эозинофилов и уровень ЛДГ на 5, 10, 15, 20, 25 и 30 дни после поступления. Мы обнаружили, что количество эозинофилов со временем увеличивалось как у тяжелых, так и у нетяжелых пациентов. Между тем, ЛДГ со временем уменьшалась (фигура 2). Тяжелые пациенты демонстрировали более медленную скорость выздоровления, чем нетяжелые пациенты. Следует отметить, что как количество эозинофилов, так и уровень ЛДГ восстанавливались медленнее у тяжелых пациентов с ХОБЛ, чем у тяжелых пациентов с хроническим бронхитом. Наши данные показывают, что по мере выздоровления заболевания количество эозинофилов и уровень ЛДГ имеют тенденцию возвращаться к нормальному диапазону как у тяжелых, так и у нетяжелых пациентов, что указывает на хороший терапевтический эффект у пациентов с хроническими заболеваниями дыхательных путей при лечении COVID-19.
Клиническая характеристика эозинофилов и ЛДГ у пациентов с COVID-19 с хроническим воспалением дыхательных путей. (А) Количество эозинофилов в разных подгруппах. Количество эозинофилов было значительно снижено у пациентов с тяжелым течением COVID-19 с хроническим бронхитом и ХОБЛ. (B) Уровни ЛДГ в разных подгруппах. Уровни ЛДГ были значительно снижены у пациентов с тяжелым течением COVID-19 с хроническим бронхитом и ХОБЛ. Значения для нетяжелых и тяжелых пациентов представлены открытыми и закрытыми кружками соответственно. Использовался U-критерий Манна-Уитни. *P<0,05, **P<0,01, ***P<0,001, ****P<0,0001. ХОБЛ, хроническая обструктивная болезнь легких; ЛДГ, лактатдегидрогеназа.
Динамические изменения количества эозинофилов и уровня ЛДГ у пациентов с COVID-19 с хроническими заболеваниями дыхательных путей. (A – D) Количество эозинофилов со временем увеличивалось у нетяжелых и тяжелых пациентов с COVID-19 с хроническим бронхитом (n = 31), ХОБЛ (n = 18) и астмой (n = 10). (E – H) Уровни ЛДГ со временем снизились у нетяжелых и тяжелых пациентов с COVID-19 с хроническим бронхитом (n = 31), ХОБЛ (n = 18) и астмой (n = 10). Значения для нетяжелых и тяжелых пациентов представлены открытыми и закрытыми кружками соответственно. Использовался U-критерий Манна-Уитни. *P<0,05, **P<0,01, ***P<0,001, ****P<0,0001 по сравнению с количеством эозинофилов или уровнями ЛДГ между тяжелыми и нетяжелыми пациентами. ХОБЛ, хроническая обструктивная болезнь легких; ЛДГ, лактатдегидрогеназа.
Далее мы провели многомерный анализ смертности у пациентов с COVID-19 с хроническим воспалением дыхательных путей, используя вышеуказанные четыре переменные, и обнаружили, что количество эозинофилов <0,02×10⁹/л (ОШ на уменьшение на одну единицу, 18 000 (95% ДИ от 1,929 до 167,986), p=0,011) был единственным независимым фактором риска смертности (онлайн дополнительная таблица 1). Более того, кривые выживаемости Каплана-Мейера показали, что пациенты с COVID-19 с эозинопенией или повышенным уровнем ЛДГ имели худшую вероятность выживания (p<0,05) (онлайн дополнительный рисунок 1). Это говорит о том, что эозинопения и повышенный уровень ЛДГ также являются потенциальными предикторами смертности у пациентов с COVID-19 с хроническими заболеваниями дыхательных путей.
Дополнительный материал
Обсуждение
В этом ретроспективном когортном исследовании мы обнаружили, что количество эозинофилов менее 0,02×10⁹/л и уровни ЛДГ более 225 Ед/л при поступлении были связаны с тяжестью заболевания COVID-19 у пациентов с хроническим бронхитом, ХОБЛ и астмой. Более того, количество эозинофилов и уровень ЛДГ имеют тенденцию возвращаться к нормальному диапазону у тяжелых и нетяжелых пациентов после лечения, что позволяет предположить их роль в качестве индикаторов прогрессирования заболевания и эффективности лечения.
Циркулирующие и тканевые эозинофилы связаны с множеством заболеваний, при которых эозинофилы участвуют в патологическом процессе и играют мощную провоспалительную роль, таких как ХОБЛ, астма и хронический бронхит. Учитывая повышенный уровень эозинофилов у пациентов с хроническим воспалением дыхательных путей, ХОБЛ, астма и хронический бронхит пока не считаются основными факторами риска тяжести инфекции SARS-CoV-2. Чжан и другие
8 сообщили, что ни у кого не было астмы или других сопутствующих атопических заболеваний, и только у двух пациентов была ХОБЛ (1,4%) в когорте из 140 госпитализированных пациентов с COVID-19, более половины из которых (53%) имели эозинопению в день госпитализации. Аналогично, Ду и другие
9 проанализировали клинические особенности 85 смертельных случаев COVID-19 и обнаружили, что у 81% пациентов при поступлении было очень низкое количество эозинофилов. В нашей когорте, включающей 1888 пациентов, у 31 пациента был хронический бронхит (1,64%), у 18 пациентов была ХОБЛ (0,95%) и только у 10 пациентов была астма (0,53%). Между тем, эозинопения чаще встречалась у пациентов в критическом состоянии, что позволяет предположить, что разрешение эозинопении может быть возможным способом улучшения клинического статуса.10 В нашем исследовании более низкое количество эозинофилов показало худшую вероятность выживания, а количество эозинофилов значительно снизилось у пациентов с тяжелым течением COVID-19 с хроническим бронхитом и ХОБЛ. У пациентов с астмой существенных различий не наблюдалось, отчасти из-за ограниченного размера выборки. Более того, еще одной более важной причиной может быть резкое увеличение количества эозинофилов в дыхательных путях у большинства пациентов с хронической астмой после бронхопровокации. Далее мы изучили динамические изменения количества эозинофилов у пациентов с хроническими заболеваниями дыхательных путей в ходе COVID-19 и обнаружили, что количество эозинофилов постепенно увеличивалось с течением времени и возвращалось к нормальному диапазону как у тяжелых, так и у нетяжелых пациентов, что могло быть возможным. показатель эффективности лечения. Остается неясным, как возникает эозинопения при COVID-19, но наиболее вероятная причина может быть связана с истощением противовирусной реакции, поскольку противовирусный ответ Th1 (Т-хелпер типа 1) подавлялся у пациентов с хроническим воспалением дыхательных путей.
Уже давно сообщалось, что ЛДГ связана с ХОБЛ, астмой и хроническим бронхитом и идентифицируется как потенциальный маркер хронического воспаления дыхательных путей.11 12 Между тем, в большом количестве исследований сообщалось о повышенном уровне ЛДГ при COVID-19, что может быть фактором риска смертности. Чжэн и другие
13 провели систематический обзор литературы и метаанализ, включая четыре исследования, и обнаружили, что уровень ЛДГ был статистически значимо выше у тяжелых пациентов по сравнению с нетяжелыми пациентами. Повышенный уровень ЛДГ в тяжелых случаях указывает на диффузное повреждение легких и тканей; поэтому мы предположили, что ЛДГ может быть еще одним предиктором обострения хронического воспаления дыхательных путей при COVID-19. Анализ выживаемости Каплана-Мейера показал опасность повышенного уровня ЛДГ. Подобно эозинофилу, уровень ЛДГ был повышен у пациентов с тяжелой формой COVID-19 с хроническим бронхитом и ХОБЛ и постепенно снижался с течением времени у пациентов с тяжелой и нетяжелой формой COVID-19.
Многочисленные исследования подчеркнули важную роль эозинопении и повышенного уровня ЛДГ в облегчении диагностики и прогнозирования тяжелой формы COVID-19. Ма и другие
14 включили эозинопению для введения шкалы COVID-19-REAL (радиологическое изображение, эозинофилы, возраст и лейкоциты), которая показала хорошие результаты при выявлении групп населения с более высоким риском заражения COVID-19. Каццанига и другие
15 сообщили, что абсолютная эозинопения в бинарном логистическом регрессионном анализе была связана с 4-недельной смертностью и клиническими исходами у пациентов с пневмонией, вызванной COVID-19.15 Гуань и другие
16 и Фэн и другие
17 оба предложили ЛДГ в качестве значимого предиктора смертности от COVID-19 и неблагоприятных исходов с помощью модели XGBoost с простым деревом, которая может помочь выявить случаи COVID-19 высокого риска. Эозинопения и повышенный уровень ЛДГ были идентифицированы как факторы риска тяжелых случаев COVID-19; однако примечательно, что в нашем исследовании они также были связаны с тяжестью течения COVID-19 у пациентов с хроническими заболеваниями дыхательных путей.
Растет обеспокоенность по поводу связи между COVID-19 и функцией легких. Предыдущие отчеты были посвящены наблюдению за дыханием после госпитализации по поводу COVID-19. Тринкманн и другие
18 обнаружили, что пациенты с симптомами имели значительно меньшие объем форсированного выдоха за 1 с, жизненную емкость легких и коэффициент переноса легких для монооксида углерода (TLCO) по сравнению с бессимптомными пациентами. Риу и другие
19 обнаружили, что пациенты с критическим заболеванием имели более низкую общую емкость легких и TLCO. Однако то, как ранее существовавшее нарушение функции легких повлияло на исход COVID-19, еще полностью не выяснено. В настоящее время соответствующей литературы недостаточно, возможно, из-за ограниченных данных о функции легких и временного закрытия лабораторий по тестированию функции легких во время пандемии COVID-19. Моргентау и другие
20 обнаружили, что смертность у пациентов с COVID-19 с саркоидозом была связана с умеренным или тяжелым нарушением функции легких. Он и другие
21 сообщили, что более длительная история ХОБЛ увеличивает риск смерти и отрицательных исходов у пациентов с COVID-19, что согласуется с работой Хэ.21 В нашей когорте нарушение функции легких у пациентов с COVID-19 с хроническими заболеваниями дыхательных путей может оказать существенное влияние на исход. Однако анализ не удалось провести из-за отсутствия данных, что было ограничением этого исследования.
Предыдущие схемы лечения могут способствовать исходу пациентов с COVID-19 с хроническими заболеваниями дыхательных путей. Ингаляционные кортикостероиды (ИГКС) (с β-агонистами длительного действия или без них) наносятся непосредственно на респираторный эпителий при лечении стабильной ХОБЛ и астмы с целью уменьшения воспаления дыхательных путей. ICS может снизить экспрессию как ACE2, так и трансмембранной протеазы серина 2 (TMPRSS2) на эпителиальных клетках дыхательных путей, впоследствии защищая их от проникновения SARS-CoV-2.22 Кроме того, с помощью ИКС также можно подавить распространение коронавируса и выработку цитокинов.23 Однако вопрос о том, повлияло ли использование регулярных ИГКС до пандемии на исходы COVID-19, остается спорным. Цвести и другие сообщили, что пациенты с астмой старше 50 лет могут получить пользу от применения ИГКС в течение 2 недель после приема, в то время как пациенты с другими хроническими заболеваниями легких не могут этого сделать.24 Шульце и другие
25Работа отрицала положительную роль регулярного применения ИГКС в защите от тяжелого исхода COVID-19 как у пациентов с астмой, так и у пациентов с ХОБЛ. В нашей когорте только один пациент с ХОБЛ и два пациента с астмой сообщили о длительном применении ИГКС из-за трудностей со сбором истории болезни в начале пандемии. Чтобы выяснить пользу или вред ИГКС при COVID-19, следует принять во внимание дополнительную подробную информацию о сопутствующих заболеваниях, предшествующем лечении и многих факторах систематической ошибки.
Различные фенотипы ХОБЛ и астмы, основанные на сложной патофизиологии, также могут быть частично вовлечены в развитие COVID-19; однако гипотезы нуждаются в дальнейшем уточнении. Кимура и другие
26 обнаружили, что воспалительные цитокины 2 типа (IL-4, IL-5, IL-13) отрицательно связаны с экспрессией ACE2, но положительно связаны с экспрессией TMPRSS2 в исследовании ex vivo. Ферастраоару и другие
27Работа показала, что фенотип астмы Th2 был предиктором снижения заболеваемости и смертности от COVID-19, в то время как Кермани и другие
28 сообщили о большей заболеваемости и смертности при нейтрофильной тяжелой астме. В предыдущем отчете подчеркивалось, что эозинофильное воспаление также является распространенным и стабильным фенотипом при ХОБЛ, а количество эозинофилов в крови может предсказать ответ на лечение ИГКС.29 Ватсон и другие не обнаружили никаких различий в экспрессии генов ACE2 при эозинофильной ХОБЛ в крови, что дополнительно указывает на то, что у этих пациентов может не быть различной уязвимости к инфекции SARS-CoV-2.30 Следовательно, то, как различные типы воспаления ХОБЛ и астмы могут повлиять на развитие тяжелой формы COVID-19, требует дальнейшего изучения.
Наше исследование также имело некоторые другие ограничения. Во-первых, из-за ретроспективного дизайна исследования точность всех лабораторных результатов зависела от медицинских записей. В этом исследовании также может существовать систематическая ошибка наблюдения из-за ограниченного размера выборки. Во-вторых, при анализе факторов риска в модели многомерной регрессии может возникнуть ошибка отбора.
Медицинский ежедневный источник