Sfondo
La SARS-CoV-2 è stata identificata per la prima volta dopo aver sequenziato campioni clinici rilevanti in una serie di casi di polmonite virale sconosciuti nel dicembre 2019 a Wuhan, nella provincia di Hubei, in Cina. COVID-19, causato da SARS-CoV-2, è stato successivamente dichiarato pandemia dall'OMS a causa della sua diffusione aggressiva su larga scala in molti paesi, che porta a migliaia di casi confermati in tutto il mondo ogni giorno. Al 15 novembre 2020, in tutto il mondo sono stati segnalati 53,7 milioni di casi confermati di COVID-19 e 1,3 milioni di decessi, il che richiede un'urgente necessità di identificazione precoce dei casi gravi.1 L'evidenza clinica di SARS-CoV-2 ha suggerito diverse vie di trasmissione tra esseri umani, con le goccioline di aerosol respiratorio che sono senza dubbio la principale fonte di infezione. SARS-CoV-2 è in grado di attaccare il sistema respiratorio legandosi ai recettori di ingresso cellulare ACE2 sulle cellule epiteliali delle vie aeree e provoca polmonite e insufficienza respiratoria nei pazienti critici.
La bronchite cronica, la broncopneumopatia cronica ostruttiva (BPCO) e l'asma sono malattie respiratorie comuni con infiammazione cronica delle vie aeree.2–4 Eosinofili, neutrofili e macrofagi nella risposta immunitaria innata aumentano significativamente nelle vie aeree e nei polmoni durante la fase iniziale dell'infiammazione. Linfocitopenia è stata segnalata in pazienti gravi con infezione da SARS-CoV-2.5 È stato anche riportato che la conta degli eosinofili circolanti è diminuita nei pazienti con COVID-19 e associata alla gravità della malattia.6 Pertanto, i pazienti con BPCO sottostante, asma e bronchite cronica possono avere stati infiammatori diversi dopo l'infezione da SARS-CoV-2 rispetto ai pazienti senza infiammazione cronica delle vie aeree.
In questo studio di coorte retrospettivo, abbiamo esaminato le cartelle cliniche di 59 pazienti con COVID-19 confermato in laboratorio con sottostante infiammazione cronica delle vie aeree e abbiamo confrontato le caratteristiche demografiche, cliniche e radiologiche, nonché i risultati di laboratorio tra pazienti gravi e non gravi in questa coorte . I potenziali predittori della gravità della malattia sono stati identificati nei risultati di laboratorio anormali utilizzando modelli di regressione univariata e multivariata.
Metodi
Popolazione di studio e raccolta dati
I soggetti di questo studio erano adulti con COVID-19 e malattie respiratorie croniche sottostanti (data di ricovero dal 26 gennaio al 3 aprile 2020) presso la filiale sino-francese della città nuova dell'ospedale Tongji. I pazienti gravi e non gravi sono stati inclusi rispettivamente nei gruppi caso e controllo. Il COVID-19 è stato diagnosticato secondo le linee guida ad interim dell'OMS.7 I pazienti con malattie respiratorie croniche sono stati diagnosticati secondo una diagnosi precedente. Tutti i pazienti sono stati confermati da risultati positivi nel test PCR della trascrittasi inversa dell'RNA SARS-CoV-2 nei campioni di tampone faringeo. Lo studio è stato condotto il 15 giugno. Le informazioni demografiche, le caratteristiche cliniche (inclusi anamnesi, sintomi, comorbidità, storia del fumo e storia allergica) e risultati radiologici di ciascun paziente sono stati ottenuti dal sistema di cartelle cliniche elettroniche della filiale sino-francese di New City del Tongji Hospital e analizzato da tre ricercatori indipendenti. La gravità di COVID-19 è stata messa in scena secondo le linee guida per la diagnosi e il trattamento di COVID-19 pubblicate dal Comitato sanitario nazionale cinese (versione 5-7).
Criteri per la gravità del COVID-19
Il COVID-19 grave è stato diagnosticato quando i pazienti soddisfacevano uno dei seguenti criteri: (1) distress respiratorio con frequenza respiratoria ≥30 al minuto; (2) saturazione di ossigeno del pulsossimetro ≤93% a riposo; e (3) indice di ossigenazione (pressione arteriosa parziale dell'ossigeno/frazione di ossigeno inspirato) ≤300 mm Hg.
Prove di laboratorio
Risultati di laboratorio medico, compreso il numero di leucociti, linfociti, monociti, eosinofili, basofili, piastrine, alanina aminotransferasi, aspartato aminotransferasi, creatina chinasi sierica, lattato deidrogenasi sierica (LDH), azoto ureico, creatinina sierica, troponina cardiaca I, concentrazioni di D -dimero, proteina C reattiva (CRP), procalcitonina, velocità di eritrosedimentazione, ferritina sierica, citochine (interleuchina (IL) 2R, IL-6, IL-8, IL-10, fattore di necrosi tumorale (TNF)-α) e funzione sono stati raccolti per ciascun paziente dalle cartelle cliniche elettroniche.
analisi statistica
Tutti i dati sono stati analizzati con SPSS Statistics Software (V.26). Le statistiche per le variabili categoriali sono state riassunte come frequenze e percentuali e sono state confrontate utilizzando χ2 test o test esatto di Fisher tra gruppi diversi, se del caso. Le variabili continue sono state descritte utilizzando la mediana (IQR) e confrontate utilizzando il test U di Mann-Whitney. Per esplorare i fattori di rischio associati alla gravità della malattia, sono stati utilizzati modelli di regressione logistica univariata e multivariata per stimare l'OR e l'IC 95%. Un α bilaterale inferiore a 0,05 è stato considerato statisticamente significativo.
Risultati
Caratteristiche demografiche e cliniche dei pazienti con COVID-19 non grave e grave con malattie croniche delle vie aeree
Sono stati ricoverati un totale di 1888 pazienti. Cinquantanove pazienti con sottostante infiammazione cronica delle vie aeree, tra cui BPCO (0,95%), asma (0,53%) e bronchite cronica (1,64%), hanno confermato l'infezione da SARS-CoV-2. Dei pazienti, 33 sono stati classificati come non gravi e 26 come gravi. Sebbene la BPCO fosse più comune nei pazienti con COVID-19 grave rispetto ai pazienti con COVID-19 non grave (42% vs 21%), la differenza non era statisticamente significativa.
L'età media di tutti i pazienti era di 71 anni (IQR, 57-80) e più della metà (54%) aveva più di 70 anni. La maggior parte (71%) dei pazienti era di sesso maschile (Tabella 1). Non c'era alcuna differenza significativa in età e sesso tra pazienti non gravi e gravi. Trentuno (53%) pazienti presentavano una o più comorbidità oltre alle tre malattie croniche delle vie aeree, con malattie cardiovascolari (46%) e malattie del sistema endocrino (15%) come comorbidità più comuni. Non ci sono state differenze significative nella presenza di queste comorbilità tra pazienti con COVID-19 non grave e grave. La metà dei pazienti aveva storie di fumo o erano fumatori attuali.
Dati demografici e caratteristiche cliniche dei pazienti con COVID-19 con infiammazione cronica delle vie aeree al momento del ricovero
I sintomi più comuni sono stati febbre (83%), tosse (73%), affaticamento (47%) e dispnea (42%). La dispnea era più comune nei pazienti gravi rispetto ai pazienti non gravi (65% vs 24%, p=0,001) (Tabella 1).
Risultati di laboratorio di pazienti con COVID-19 non grave e grave con malattie croniche delle vie aeree
Rispetto ai pazienti non gravi, i pazienti gravi avevano maggiori probabilità di avere una conta dei neutrofili elevata (8,2×10⁹/L vs 4,1×10⁹/L, p=0,001), una conta dei linfociti ridotta (0,6×10⁹/L vs 1,1×10⁹/ L, p<0,001), eosinopenia (<0,02×10⁹/L; 73% vs 24%, p<0,001), D-dimero elevato (>1 µg/mL; 88% vs 42%, p=0,001), aumento di LDH (471,0 U /L vs 230,0 U/L, p<0,001), aumento dell'azoto ureico nel sangue (>9,5 mmol/L; 42% vs 3%, p<0,001), aumento della troponina I ipersensibile (>34 pg/mL; 48% vs 7%, p= 0,001) e aumento dei marcatori di infiammazione tra cui CRP (126,2 mg/L vs 19,9 mg/L, p<0,001), procalcitonina (≥0,05 ng/mL; 96% vs 43%, p<0,001) e ferritina (1264,2 mg/L vs 293,6 mg/l, p=0,004) (Tavolo 2). Da notare che tra i due gruppi sono state osservate differenze significative nell'espressione delle citochine correlate all'infiammazione, tra cui IL-6, IL-8 e TNF-α, che sono state notevolmente aumentate nei pazienti gravi.
Risultati di laboratorio di pazienti con COVID-19 con infiammazione cronica delle vie aeree al momento del ricovero
Predittori di gravità di COVID-19 in pazienti con malattie croniche delle vie aeree
Per identificare i predittori di gravità di COVID-19 nei pazienti con malattie croniche delle vie aeree, abbiamo analizzato l'associazione tra risultati di laboratorio anormali e gravità della malattia con modelli di regressione logistica univariata e multivariata. La gravità della malattia era significativamente associata a tutti i risultati di laboratorio anormali sopra menzionati nelle analisi di regressione logistica univariata. In un modello di regressione multivariata che comprendeva linfopenia, eosinopenia, aumento di LDH e aumento di IL-6, conta degli eosinofili <0,02×10⁹/L (OR per diminuzione di una unità, 10,115 (95% CI da 2,158 a 47,414), p=0,003) e LDH livello >225 U/L (OR per aumento di una unità, 22.300 (95% CI da 2.179 a 228.247), p=0.009) erano fattori di rischio indipendenti per la gravità della malattia (tavola 3). I nostri dati suggeriscono che la diminuzione della conta degli eosinofili e l'aumento dei livelli di LDH possono aiutare i medici a identificare il COVID-19 grave nei pazienti con malattie croniche delle vie aeree.
Predittori di gravità di COVID-19 in pazienti con malattie croniche delle vie aeree
La conta degli eosinofili e i livelli di LDH tendono a tornare alla normalità nel tempo nei pazienti non gravi
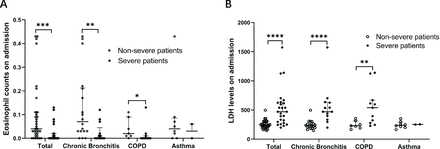
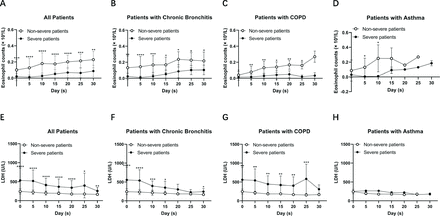
Abbiamo analizzato ulteriormente la conta degli eosinofili e i livelli di LDH in pazienti con COVID-19 non grave e grave con bronchite cronica, BPCO e asma, rispettivamente. Abbiamo scoperto che c'era una differenza significativa nella conta degli eosinofili e nei livelli di LDH tra pazienti gravi e non gravi con bronchite cronica e BPCO, ma non nei pazienti con asma.Figura 1). Per osservare i cambiamenti dinamici della conta degli eosinofili e dei livelli di LDH nel tempo, abbiamo raccolto i conteggi degli eosinofili e i livelli di LDH il 5°, 10°, 15°, 20°, 25° e 30° giorno dopo il ricovero. Abbiamo scoperto che la conta degli eosinofili è aumentata nel tempo sia nei pazienti gravi che in quelli non gravi. Nel frattempo, LDH è diminuito nel tempo (figura 2). I pazienti gravi hanno mostrato un tasso di recupero più lento rispetto ai pazienti non gravi. Da notare che sia la conta degli eosinofili che i livelli di LDH si sono ripresi più lentamente nei pazienti gravi con BPCO rispetto a quelli nei pazienti gravi con bronchite cronica. I nostri dati suggeriscono che, con la guarigione della malattia, la conta degli eosinofili e i livelli di LDH tendono a tornare al range normale sia nei pazienti gravi che in quelli non gravi, indicando un buon effetto terapeutico nei pazienti con malattie croniche delle vie aeree nel trattamento del COVID-19.
Caratteristiche cliniche di eosinofili e LDH in pazienti con COVID-19 con infiammazione cronica delle vie aeree. (A) Conta degli eosinofili in diversi sottogruppi. La conta degli eosinofili era significativamente ridotta nei pazienti con COVID-19 grave con bronchite cronica e BPCO. (B) Livelli di LDH in diversi sottogruppi. I livelli di LDH erano significativamente diminuiti nei pazienti con COVID-19 grave con bronchite cronica e BPCO. I valori per i pazienti non gravi e gravi sono presentati rispettivamente con cerchi aperti e chiusi. È stato utilizzato il test U di Mann-Whitney. *P<0,05, **P<0,01, ***P<0,001, ****P<0,0001. BPCO, broncopneumopatia cronica ostruttiva; LDH, lattato deidrogenasi.
Cambiamenti dinamici della conta degli eosinofili e dei livelli di LDH in pazienti con COVID-19 con malattie croniche delle vie aeree. (A–D) La conta degli eosinofili è aumentata nel tempo nei pazienti non gravi e gravi con COVID-19 con bronchite cronica (n=31), BPCO (n=18) e asma (n=10). (E–H) I livelli di LDH sono diminuiti nel tempo nei pazienti non gravi e gravi con COVID-19 con bronchite cronica (n=31), BPCO (n=18) e asma (n=10). I valori per i pazienti non gravi e gravi sono presentati rispettivamente con cerchi aperti e chiusi. È stato utilizzato il test U di Mann-Whitney. * P <0, 05, ** P <0, 01, *** P <0, 001, **** P <0, 0001, rispetto alla conta degli eosinofili o ai livelli di LDH tra pazienti gravi e non gravi. BPCO, broncopneumopatia cronica ostruttiva; LDH, lattato deidrogenasi.
Abbiamo inoltre eseguito un'analisi multivariata per la mortalità nei pazienti con COVID-19 con infiammazione cronica delle vie aeree utilizzando le quattro variabili di cui sopra e abbiamo scoperto che la conta degli eosinofili <0,02 × 10⁹/L (OR per diminuzione di una unità, 18.000 (95% CI da 1,929 a 167,986), p=0,011) era l'unico fattore di rischio indipendente per la mortalità (tabella supplementare online 1). Inoltre, le curve di sopravvivenza di Kaplan-Meier hanno indicato che i pazienti con COVID-19 con eosinopenia o LDH elevato avevano una probabilità di sopravvivenza peggiore (p<0,05) (figura supplementare online 1). Ciò suggerisce che l'eosinopenia e l'elevata LDH sono anche potenziali predittori di mortalità nei pazienti con COVID-19 con sottostanti malattie croniche delle vie aeree.
Materiale supplementare
Discussione
In questo studio di coorte retrospettivo, abbiamo scoperto che una conta degli eosinofili inferiore a 0,02×10⁹/L e livelli di LDH superiori a 225 U/L al momento del ricovero erano associati alla gravità del COVID-19 nei pazienti con sottostante bronchite cronica, BPCO e asma. Inoltre, la conta degli eosinofili e i livelli di LDH tendono a tornare alla normalità nei pazienti gravi e non gravi dopo il trattamento, suggerendo il loro ruolo come indicatori della progressione della malattia e dell'efficacia del trattamento.
Gli eosinofili circolanti e residenti nei tessuti sono associati a una varietà di malattie, in cui gli eosinofili partecipano al processo patologico e svolgono un potente ruolo proinfiammatorio, come la BPCO, l'asma e la bronchite cronica. In considerazione degli eosinofili elevati nei pazienti con infiammazione cronica delle vie aeree, BPCO, asma e bronchite cronica non sono stati ancora segnalati come principali fattori di rischio per la gravità delle infezioni da SARS-CoV-2. Zhang et al
8 hanno riferito che nessuno aveva asma o altre malattie atopiche comorbide e solo due pazienti avevano BPCO (1.4%) in una coorte di 140 pazienti ospedalizzati con COVID-19, più della metà dei quali (53%) aveva eosinopenia il giorno del ricovero in ospedale. Allo stesso modo Du et al
9 ha analizzato le caratteristiche cliniche di 85 casi fatali di COVID-19 e ha scoperto che 81% dei pazienti presentava conte di eosinofili molto basse al momento del ricovero. Nella nostra coorte comprendente 1888 pazienti, 31 pazienti avevano bronchite cronica (1.64%), 18 pazienti avevano BPCO (0.95%) e solo 10 pazienti avevano asma (0.53%). Nel frattempo, l'eosinopenia era più comune nei pazienti critici, suggerendo che la risoluzione dell'eosinopenia potrebbe essere un possibile modo per migliorare lo stato clinico.10 Nel nostro studio, un numero inferiore di eosinofili ha mostrato una peggiore probabilità di sopravvivenza e il numero di eosinofili è diminuito significativamente nei pazienti con COVID-19 grave con bronchite cronica e BPCO. Nessuna differenza significativa è stata osservata nei pazienti con asma, in parte a causa della dimensione limitata del campione. Inoltre, il drastico aumento della conta degli eosinofili nelle vie aeree della maggior parte dei pazienti con asma cronico dopo broncoprovocazione potrebbe essere un'altra causa più importante. Abbiamo esplorato ulteriormente i cambiamenti dinamici della conta degli eosinofili nei pazienti con malattie croniche delle vie aeree nel corso di COVID-19 e abbiamo scoperto che la conta degli eosinofili è aumentata gradualmente nel tempo ed è tornata al range normale sia nei pazienti gravi che in quelli non gravi, il che potrebbe essere un possibile indicatore di efficacia del trattamento. Non è chiaro come si svolga l'eosinopenia in COVID-19, ma la ragione più possibile potrebbe essere dovuta al suo esaurimento della reazione antivirale, poiché la risposta antivirale Th1 (Tipo 1 T helper) è stata inibita in quei pazienti con infiammazione cronica delle vie aeree.
È stato a lungo segnalato che LDH è associato a BPCO, asma e bronchite cronica e identificato come un potenziale marker di infiammazione cronica delle vie aeree.11 12 Nel frattempo, un gran numero di studi ha riportato livelli elevati di LDH in COVID-19, che potrebbero essere un fattore di rischio per la mortalità. Zheng et al
13 ha condotto una revisione sistematica della letteratura e una meta-analisi comprendente quattro studi e ha scoperto che l'LDH era statisticamente significativamente più alto nei pazienti gravi rispetto ai pazienti non gravi. LDH elevato nei casi gravi indicava lesioni polmonari diffuse e danni ai tessuti; pertanto, abbiamo ipotizzato che LDH potrebbe essere un altro predittore di esacerbazione dell'infiammazione cronica delle vie aeree in COVID-19. L'analisi di sopravvivenza di Kaplan-Meier ha suggerito il rischio di livelli elevati di LDH. Simile all'eosinofilo, LDH ha mostrato livelli elevati nei pazienti con COVID-19 grave con bronchite cronica e BPCO e gradualmente diminuito nel tempo nei pazienti con COVID-19 grave e non grave.
Numerose ricerche hanno evidenziato i ruoli importanti dell'eosinopenia e dell'elevata LDH nel facilitare la diagnosi e la prognosi del COVID-19 grave. Mamma et al
14 incluso l'eosinopenia per introdurre il punteggio COVID-19-REAL (immagine radiologica, eosinofili, età e leucociti), che ha avuto una buona performance nell'identificare le popolazioni a più alto rischio di contrarre il COVID-19. Cazzaniga et al
15 hanno riferito che l'eosinopenia assoluta nelle analisi di regressione logistica binaria era associata alla mortalità a 4 settimane e agli esiti clinici nei pazienti con polmonite da COVID-19.15 Guan et al
16 e Feng et al
17 entrambi hanno proposto LDH come predittore significativo della mortalità COVID-19 e degli esiti avversi con il modello XGBoost ad albero semplice, che può aiutare a identificare i casi COVID-19 ad alto rischio. L'eosinopenia e l'elevata LDH sono stati identificati come fattori di rischio per casi gravi di COVID-19; tuttavia, è interessante notare che nel nostro studio erano anche associati alla gravità del COVID-19 nei pazienti con malattie croniche delle vie aeree.
C'è una crescente preoccupazione per quanto riguarda l'associazione tra COVID-19 e la funzione polmonare. Rapporti precedenti si sono concentrati sul follow-up respiratorio dopo il ricovero per COVID-19. Trinkmann et al
18 trovato che i pazienti sintomatici avevano un volume espiratorio forzato significativamente inferiore in 1 s, capacità vitale e fattore di trasferimento del polmone per il monossido di carbonio (TLCO) rispetto ai pazienti asintomatici. Riou et al
19 ha scoperto che i pazienti con malattia critica avevano una capacità polmonare totale inferiore e TLCO. Tuttavia, il modo in cui la compromissione della funzione polmonare preesistente ha influito sull'esito di COVID-19 non è stato ancora completamente chiarito. Attualmente, la letteratura correlata è scarsa, probabilmente a causa dei dati limitati sulla funzionalità polmonare e della chiusura temporanea dei laboratori di test della funzionalità polmonare durante la pandemia di COVID-19. Morgenthau et al
20 hanno scoperto che la mortalità nei pazienti con COVID-19 con sarcoidosi era associata a compromissione moderata o grave della funzione polmonare. Lui et al
21 ha riferito che una storia più lunga di BPCO ha aumentato il rischio di morte e di esiti negativi dei pazienti con COVID-19, il che era coerente con il lavoro di He.21 Nella nostra coorte, la compromissione della funzionalità polmonare dei pazienti con COVID-19 con malattie croniche delle vie aeree sottostanti potrebbe avere un impatto significativo sull'esito. Tuttavia, non è stato possibile condurre l'analisi a causa della mancanza di dati, il che rappresentava un limite di questo studio.
I regimi terapeutici precedenti potrebbero contribuire all'esito dei pazienti con COVID-19 con malattie croniche sottostanti delle vie aeree. I corticosteroidi inalatori (ICS) (con o senza β-agonisti a lunga durata d'azione) vengono applicati direttamente all'epitelio respiratorio nell'intervento di BPCO stabile e asma per ridurre l'infiammazione delle vie aeree. L'ICS potrebbe diminuire l'espressione sia di ACE2 che della proteasi transmembrana serina 2 (TMPRSS2) sulle cellule epiteliali delle vie aeree, proteggendole successivamente dall'invasione di SARS-CoV-2.22 Inoltre, la proliferazione del coronavirus e la produzione di citochine potrebbero anche essere soppresse dall'uso di ICS.23 Tuttavia, rimane controverso se l'uso di ICS regolari prima della pandemia abbia avuto un impatto sugli esiti di COVID-19. Fioritura et al hanno riferito che i pazienti con asma di età superiore ai 50 anni potrebbero trarre beneficio dall'uso di ICS entro 2 settimane dal ricovero, mentre i pazienti con altre malattie polmonari croniche no.24 Schultze et al
25Il lavoro di ha negato il ruolo positivo dell'uso regolare di ICS nella protezione contro gravi esiti di COVID-19, sia nei pazienti con asma che nei pazienti con BPCO. Nella nostra coorte, solo un paziente con BPCO e due pazienti con asma hanno riferito di aver fatto uso a lungo termine di ICS a causa della difficoltà nel raccogliere anamnesi all'inizio della pandemia. Ulteriori informazioni dettagliate su comorbilità, farmaci precedenti e molti fattori di distorsione dovrebbero essere prese in considerazione per capire i benefici o i danni degli ICS in COVID-19.
Diversi fenotipi di BPCO e asma basati sulla complessa fisiopatologia potrebbero anche essere parzialmente coinvolti in COVID-19; tuttavia, le ipotesi devono essere ulteriormente chiarite. Chimura et al
26 scoperto che le citochine infiammatorie di tipo 2 (IL-4, IL-5, IL-13) erano associate negativamente all'espressione di ACE2 mentre erano associate positivamente all'espressione di TMPRSS2 in uno studio ex vivo. Ferastraoaru et al
27Il lavoro di Kermani ha indicato che un fenotipo di asma Th2 era un predittore di ridotta morbilità e mortalità da COVID-19, mentre Kermani et al
28 hanno riportato una maggiore morbilità e mortalità nell'asma neutrofilo grave. Un precedente rapporto ha evidenziato che l'infiammazione eosinofila era anche un fenotipo comune e stabile nella BPCO e che la conta degli eosinofili nel sangue poteva predire la risposta al trattamento con ICS.29 Watson et al non ha trovato alcuna differenza di espressione genica in ACE2 nella BPCO eosinofila nel sangue, indicando ulteriormente che questi pazienti potrebbero non avere una diversa vulnerabilità all'infezione da SARS-CoV-2.30 Pertanto, il modo in cui i diversi tipi di infiammazione della BPCO e dell'asma potrebbero influire sul progresso del COVID-19 grave necessita di ulteriori indagini.
Il nostro studio presentava anche altri limiti. In primo luogo, a causa del disegno dello studio retrospettivo, l'accuratezza di tutti i risultati di laboratorio dipendeva dalle cartelle cliniche. Bias di osservazione potrebbe esistere anche in questo studio a causa della dimensione limitata del campione. In secondo luogo, potrebbe esserci un bias di selezione nel modello di regressione multivariata durante l'analisi dei fattori di rischio.