Arrière-plan
Le SRAS-CoV-2 a été identifié pour la première fois après le séquençage d’échantillons cliniques pertinents dans un groupe de cas inconnus de pneumonie virale en décembre 2019 à Wuhan, province du Hubei, en Chine. Le COVID-19, causé par le SRAS-CoV-2, a ensuite été déclaré pandémie par l’OMS en raison de sa propagation agressive à grande échelle dans de nombreux pays, entraînant chaque jour des milliers de cas confirmés dans le monde. Au 15 novembre 2020, 53,7 millions de cas confirmés de COVID-19 et 1,3 million de décès avaient été signalés dans le monde, ce qui exige une identification urgente des cas graves.1 Les preuves cliniques du SRAS-CoV-2 ont suggéré plusieurs voies de transmission entre humains, les gouttelettes d'aérosol respiratoire étant sans aucun doute la principale source d'infection. Le SRAS-CoV-2 est capable d’attaquer le système respiratoire en se liant aux récepteurs d’entrée cellulaire ACE2 sur les cellules épithéliales des voies respiratoires et entraîne une pneumonie et une insuffisance respiratoire chez les patients gravement malades.
La bronchite chronique, la maladie pulmonaire obstructive chronique (MPOC) et l'asthme sont des maladies respiratoires courantes accompagnées d'inflammation chronique des voies respiratoires.2 à 4 Les éosinophiles, les neutrophiles et les macrophages de la réponse immunitaire innée augmentent considérablement dans les voies respiratoires et les poumons au cours de la phase initiale de l'inflammation. Une lymphocytopénie a été rapportée chez des patients sévèrement infectés par le SRAS-CoV-2.5 Il a également été rapporté que le nombre d’éosinophiles circulants était diminué chez les patients atteints de COVID-19 et associé à la gravité de la maladie.6 Par conséquent, les patients souffrant de BPCO, d’asthme et de bronchite chronique sous-jacents peuvent présenter des états inflammatoires différents après une infection par le SRAS-CoV-2 par rapport aux patients sans inflammation chronique des voies respiratoires.
Dans cette étude de cohorte rétrospective, nous avons examiné les dossiers médicaux de 59 patients atteints de COVID-19 confirmé en laboratoire avec une inflammation chronique sous-jacente des voies respiratoires et comparé les caractéristiques démographiques, cliniques et radiologiques ainsi que les résultats de laboratoire entre les patients sévères et non sévères de cette cohorte. . Des facteurs prédictifs potentiels de la gravité de la maladie ont été identifiés dans les résultats anormaux de laboratoire à l'aide de modèles de régression univariés et multivariés.
Méthodes
Population étudiée et collecte de données
Les sujets de cette étude étaient des adultes atteints de COVID-19 et de maladies respiratoires chroniques sous-jacentes (date d'admission du 26 janvier au 3 avril 2020) à la branche sino-française de la nouvelle ville de l'hôpital de Tongji. Les patients sévères et non sévères ont été inclus respectivement dans les groupes de cas et de contrôle. Le COVID-19 a été diagnostiqué conformément aux directives provisoires de l’OMS.7 Les patients atteints de maladies respiratoires chroniques ont été diagnostiqués selon un diagnostic préalable. Tous les patients ont été confirmés par des résultats positifs lors du test PCR par transcriptase inverse de l’ARN du SRAS-CoV-2 dans des échantillons prélevés sur un écouvillon de gorge. L'étude a été menée le 15 juin. Les informations démographiques, les caractéristiques cliniques (y compris les antécédents médicaux, les symptômes, les comorbidités, les antécédents de tabagisme et les antécédents allergiques) et les résultats radiologiques de chaque patient ont été obtenus à partir du système de dossier médical électronique de la succursale sino-française de la nouvelle ville. de l'hôpital Tongji et analysé par trois chercheurs indépendants. La gravité du COVID-19 a été classée selon les lignes directrices pour le diagnostic et le traitement du COVID-19 publiées par le Comité national chinois de la santé (versions 5 à 7).
Critères de gravité du COVID-19
Un COVID-19 sévère a été diagnostiqué lorsque les patients répondaient à l'un des critères suivants : (1) détresse respiratoire avec une fréquence respiratoire ≥ 30 par minute ; (2) saturation en oxygène de l'oxymètre de pouls ≤93% au repos ; et (3) indice d'oxygénation (pression partielle artérielle d'oxygène/fraction d'oxygène inspirée) ≤300 mm Hg.
Tests en laboratoire
Résultats de laboratoire médical, y compris nombre de leucocytes, lymphocytes, monocytes, éosinophiles, basophiles, plaquettes, alanine aminotransférase, aspartate aminotransférase, créatine kinase sérique, lactate déshydrogénase sérique (LDH), azote uréique du sang, créatinine sérique, troponine I cardiaque, concentrations de D -dimères, protéine C réactive (CRP), procalcitonine, vitesse de sédimentation des érythrocytes, ferritine sérique, cytokines (interleukine (IL) 2R, IL-6, IL-8, IL-10, facteur de nécrose tumorale (TNF)-α) et système immunitaire Les fonctions ont été collectées pour chaque patient à partir des dossiers médicaux électroniques.
analyses statistiques
Toutes les données ont été analysées avec le logiciel SPSS Statistics (V.26). Les statistiques des variables catégorielles ont été résumées sous forme de fréquences et de pourcentages et comparées à l'aide de χ2 test ou test exact de Fisher entre différents groupes, le cas échéant. Les variables continues ont été décrites à l'aide de la médiane (IQR) et comparées à l'aide du test U de Mann-Whitney. Pour explorer les facteurs de risque associés à la gravité de la maladie, des modèles de régression logistique univariée et multivariée ont été utilisés pour estimer l'OR et l'IC 95%. Un α bilatéral inférieur à 0,05 était considéré comme statistiquement significatif.
Résultats
Caractéristiques démographiques et cliniques des patients atteints de COVID-19 non grave et sévère atteints de maladies chroniques des voies respiratoires
Au total, 1 888 patients ont été admis. Cinquante-neuf patients présentant une inflammation chronique sous-jacente des voies respiratoires, notamment une BPCO (0,95%), de l'asthme (0,53%) et une bronchite chronique (1,64%), ont été confirmés comme étant infectés par le SRAS-CoV-2. Parmi les patients, 33 ont été classés comme non graves et 26 comme sévères. Bien que la BPCO ait été plus fréquente chez les patients atteints de COVID-19 sévère que chez les patients atteints de COVID-19 non sévère (42% contre 21%), la différence n’était pas statistiquement significative.
L'âge médian de tous les patients était de 71 ans (IQR, 57-80) et plus de la moitié (54%) avaient plus de 70 ans. La majorité (71%) des patients étaient des hommes (Tableau 1). Il n’y avait pas de différence significative d’âge et de sexe entre les patients non sévères et sévères. Trente et un patients (53%) présentaient une ou plusieurs comorbidités en plus des trois maladies chroniques des voies respiratoires, les maladies cardiovasculaires (46%) et les maladies du système endocrinien (15%) étant les comorbidités les plus courantes. Il n’y avait aucune différence significative dans la présence de ces comorbidités entre les patients atteints de COVID-19 non sévère et sévère. La moitié des patients avaient des antécédents de tabagisme ou étaient des fumeurs actuels.
Caractéristiques démographiques et cliniques des patients atteints de COVID-19 présentant une inflammation chronique des voies respiratoires à l'admission
Les symptômes les plus courants étaient la fièvre (83%), la toux (73%), la fatigue (47%) et la dyspnée (42%). La dyspnée était plus fréquente chez les patients sévères que chez les patients non sévères (65% vs 24%, p = 0,001) (Tableau 1).
Résultats de laboratoire de patients atteints de COVID-19 non grave et grave atteints de maladies chroniques des voies respiratoires
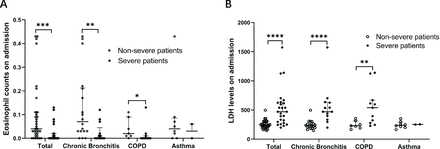
Par rapport aux patients non sévères, les patients graves étaient plus susceptibles d'avoir un nombre élevé de neutrophiles (8,2 × 10⁹/L contre 4,1 × 10⁹/L, p = 0,001), une diminution du nombre de lymphocytes (0,6 × 10⁹/L contre 1,1 × 10⁹/L). L, p<0,001), éosinopénie (<0,02×10⁹/L ; 73% vs 24%, p<0,001), D-dimères élevée (>1 µg/mL ; 88% vs 42%, p=0,001), augmentation de la LDH (471,0 U /L vs 230,0 U/L, p<0,001), azote uréique sanguin élevé (>9,5 mmol/L ; 42% vs 3%, p<0,001), augmentation de la troponine I hypersensible (>34 pg/mL ; 48% vs 7%, p= 0,001) et une augmentation des marqueurs d'inflammation, notamment la CRP (126,2 mg/L contre 19,9 mg/L, p<0,001), la procalcitonine (≥0,05 ng/mL ; 96% contre 43%, p<0,001) et la ferritine (1 264,2 mg/L contre 293,6). mg/L, p=0,004) (Tableau 2). Il convient de noter que des différences significatives dans l'expression des cytokines liées à l'inflammation, notamment l'IL-6, l'IL-8 et le TNF-α, ont été observées entre les deux groupes, qui ont été considérablement augmentées chez les patients sévères.
Résultats de laboratoire de patients atteints de COVID-19 présentant une inflammation chronique des voies respiratoires à l'admission
Prédicteurs de la gravité du COVID-19 chez les patients atteints de maladies chroniques des voies respiratoires
Pour identifier les prédicteurs de la gravité du COVID-19 chez les patients atteints de maladies chroniques des voies respiratoires, nous avons analysé l'association entre les résultats de laboratoire anormaux et la gravité de la maladie avec des modèles de régression logistique univariés et multivariés. La gravité de la maladie était associée de manière significative à tous les résultats de laboratoire anormaux mentionnés ci-dessus dans les analyses de régression logistique univariée. Dans un modèle de régression multivarié intégrant la lymphopénie, l'éosinopénie, une élévation de la LDH et une augmentation de l'IL-6, le nombre d'éosinophiles <0,02 × 10⁹/L (OR par diminution d'une unité, 10,115 (95% IC 2,158 à 47,414), p = 0,003) et la LDH un niveau > 225 U/L (OR par augmentation d'une unité, 22,300 (IC 95% 2,179 à 228,247), p = 0,009) étaient des facteurs de risque indépendants pour la gravité de la maladie (Tableau 3). Nos données suggèrent qu’une diminution du nombre d’éosinophiles et une augmentation des taux de LDH pourraient aider les cliniciens à identifier les cas graves de COVID-19 chez les patients atteints de maladies chroniques des voies respiratoires.
Prédicteurs de la gravité du COVID-19 chez les patients atteints de maladies chroniques des voies respiratoires
Le nombre d'éosinophiles et les taux de LDH ont tendance à revenir à la normale avec le temps chez les patients non sévères.
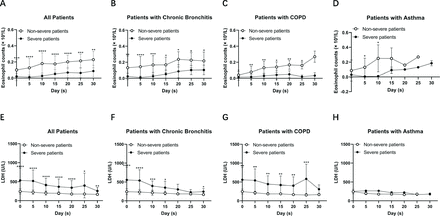
Nous avons en outre analysé le nombre d'éosinophiles et les niveaux de LDH chez les patients atteints de COVID-19 non sévère et sévère atteints de bronchite chronique, de BPCO et d'asthme, respectivement. Nous avons constaté qu'il existait une différence significative dans le nombre d'éosinophiles et les taux de LDH entre les patients atteints de bronchite chronique et de BPCO sévères et non sévères, mais pas chez les patients asthmatiques (Figure 1). Pour observer les changements dynamiques du nombre d'éosinophiles et des taux de LDH au fil du temps, nous avons collecté les taux d'éosinophiles et les taux de LDH les 5e, 10e, 15e, 20e, 25e et 30e jours après l'admission. Nous avons constaté que le nombre d'éosinophiles augmentait avec le temps, tant chez les patients sévères que non sévères. Pendant ce temps, la LDH a diminué avec le temps (Figure 2). Les patients sévères ont montré un taux de récupération plus lent que les patients non graves. Il convient de noter que le nombre d’éosinophiles et les taux de LDH se sont rétablis plus lentement chez les patients atteints de BPCO sévère que chez les patients atteints de bronchite chronique sévère. Nos données suggèrent qu'à mesure que la maladie se rétablit, le nombre d'éosinophiles et les taux de LDH ont tendance à revenir à la normale chez les patients sévères et non sévères, ce qui indique un bon effet thérapeutique chez les patients atteints de maladies chroniques des voies respiratoires dans le traitement du COVID-19.
Caractéristiques cliniques de l'éosinophile et de la LDH chez les patients atteints de COVID-19 présentant une inflammation chronique des voies respiratoires. (A) Les éosinophiles comptent dans différents sous-groupes. Le nombre d’éosinophiles a été significativement diminué chez les patients atteints de COVID-19 sévère avec bronchite chronique et BPCO. (B) Niveaux de LDH dans différents sous-groupes. Les niveaux de LDH étaient significativement diminués chez les patients atteints de COVID-19 sévère avec bronchite chronique et BPCO. Les valeurs pour les patients non sévères et sévères sont présentées respectivement par des cercles ouverts et fermés. Le test U de Mann-Whitney a été utilisé. *P<0,05, **P<0,01, ***P<0,001, ****P<0,0001. BPCO, maladie pulmonaire obstructive chronique ; LDH, lactate déshydrogénase.
Modifications dynamiques du nombre d'éosinophiles et des niveaux de LDH chez les patients atteints de COVID-19 atteints de maladies chroniques des voies respiratoires. (A – D) Le nombre d’éosinophiles a augmenté avec le temps chez les patients atteints de COVID-19 non sévères et sévères souffrant de bronchite chronique (n = 31), de BPCO (n = 18) et d’asthme (n = 10). (E – H) Les niveaux de LDH ont diminué au fil du temps chez les patients atteints de COVID-19 non sévères et sévères atteints de bronchite chronique (n = 31), de BPCO (n = 18) et d'asthme (n = 10). Les valeurs pour les patients non sévères et sévères sont présentées respectivement par des cercles ouverts et fermés. Le test U de Mann-Whitney a été utilisé. * P <0,05, ** P <0,01, *** P <0,001, **** P <0,0001, comparé au nombre d'éosinophiles ou aux niveaux de LDH entre les patients sévères et non sévères. BPCO, maladie pulmonaire obstructive chronique ; LDH, lactate déshydrogénase.
Nous avons en outre effectué une analyse multivariée de la mortalité chez les patients atteints de COVID-19 présentant une inflammation chronique des voies respiratoires en utilisant les quatre variables ci-dessus et avons constaté que le nombre d'éosinophiles <0,02 × 10⁹/L (RC par diminution d'une unité, 18 000 (IC 95% 1,929 à 167,986), p=0,011) était le seul facteur de risque indépendant de mortalité (tableau supplémentaire en ligne 1). De plus, les courbes de survie de Kaplan-Meier ont indiqué que les patients atteints de COVID-19 présentant une éosinopénie ou une LDH élevée avaient une probabilité de survie plus faible (p < 0,05) (figure supplémentaire 1 en ligne). Cela suggère que l’éosinopénie et une LDH élevée sont également des prédicteurs potentiels de mortalité chez les patients atteints de COVID-19 présentant des maladies chroniques des voies respiratoires sous-jacentes.
Matériel supplémentaire
Discussion
Dans cette étude de cohorte rétrospective, nous avons constaté que des taux d'éosinophiles inférieurs à 0,02 × 10⁹/L et des taux de LDH supérieurs à 225 U/L à l'admission étaient associés à la gravité du COVID-19 chez les patients souffrant de bronchite chronique sous-jacente, de BPCO et d'asthme. De plus, le nombre d'éosinophiles et les taux de LDH ont tendance à revenir à la normale chez les patients sévères et non sévères après le traitement, ce qui suggère leur rôle en tant qu'indicateurs de la progression de la maladie et de l'efficacité du traitement.
Les éosinophiles circulants et résidant dans les tissus sont associés à diverses maladies dans lesquelles les éosinophiles participent au processus pathologique et jouent un rôle proinflammatoire puissant, telles que la BPCO, l'asthme et la bronchite chronique. Compte tenu des éosinophiles élevés chez les patients souffrant d’inflammation chronique des voies respiratoires, la BPCO, l’asthme et la bronchite chronique n’ont pas encore été signalés comme facteurs de risque majeurs de gravité des infections par le SRAS-CoV-2. Zhang et al
8 ont rapporté qu'aucun ne souffrait d'asthme ou d'autres maladies atopiques comorbides et que seuls deux patients souffraient de BPCO (1,4%) dans une cohorte de 140 patients hospitalisés atteints de COVID-19, dont plus de la moitié (53%) souffraient d'éosinopénie le jour de leur admission à l'hôpital. De même, Du et al
9 a analysé les caractéristiques cliniques de 85 cas mortels de COVID-19 et a découvert que le 81% des patients présentait un nombre d'éosinophiles très faible à l'admission. Dans notre cohorte comprenant 1888 patients, 31 patients avaient une bronchite chronique (1,64%), 18 patients avaient une BPCO (0,95%) et seulement 10 patients avaient de l'asthme (0,53%). Pendant ce temps, l’éosinopénie était plus fréquente chez les patients gravement sévères, ce qui suggère que la résolution de l’éosinopénie pourrait être un moyen possible d’améliorer l’état clinique.10 Dans notre étude, un nombre plus faible d’éosinophiles a montré une probabilité de survie plus faible, et le nombre d’éosinophiles a diminué de manière significative chez les patients atteints de COVID-19 sévère souffrant de bronchite chronique et de BPCO. Aucune différence significative n’a été observée chez les patients asthmatiques, en partie à cause de la taille limitée de l’échantillon. De plus, une augmentation drastique du nombre d’éosinophiles dans les voies respiratoires de la plupart des patients souffrant d’asthme chronique après une bronchoprovocation pourrait être une autre cause plus importante. Nous avons en outre exploré les changements dynamiques du nombre d'éosinophiles chez les patients atteints de maladies chroniques des voies respiratoires au cours de la COVID-19 et avons constaté que le nombre d'éosinophiles augmentait progressivement avec le temps et revenait à la normale chez les patients graves et non graves, ce qui pourrait être une possible indicateur de l’efficacité du traitement. On ne sait pas exactement comment l’éosinopénie se produit dans le COVID-19, mais la raison la plus possible pourrait être due à l’épuisement de la réaction antivirale, puisque la réponse antivirale Th1 (assistant T de type 1) a été inhibée chez les patients présentant une inflammation chronique des voies respiratoires.
La LDH est depuis longtemps associée à la BPCO, à l’asthme et à la bronchite chronique et identifiée comme un marqueur potentiel de l’inflammation chronique des voies respiratoires.11 12 Parallèlement, un grand nombre d’études ont rapporté des taux élevés de LDH dans le COVID-19, ce qui pourrait constituer un facteur de risque de mortalité. Zheng et al
13 a mené une revue systématique de la littérature et une méta-analyse incluant quatre études et a constaté que la LDH était statistiquement significativement plus élevée chez les patients sévères que chez les patients non sévères. Une LDH élevée dans les cas graves indiquait une lésion pulmonaire diffuse et des lésions tissulaires ; par conséquent, nous avons émis l’hypothèse que la LDH pourrait être un autre prédicteur de l’exacerbation de l’inflammation chronique des voies respiratoires dans le cas du COVID-19. L'analyse de survie de Kaplan-Meier a suggéré le risque de niveaux élevés de LDH. Semblable à l’éosinophile, la LDH a montré des niveaux élevés chez les patients atteints de COVID-19 sévère souffrant de bronchite chronique et de BPCO et ont progressivement diminué au fil du temps chez les patients atteints de COVID-19 sévère et non sévère.
De multiples recherches ont mis en évidence les rôles importants de l’éosinopénie et d’une LDH élevée pour faciliter le diagnostic et le pronostic du COVID-19 sévère. Maman et al
14 inclus l’éosinopénie pour introduire le score COVID-19-REAL (image radiologique, éosinophiles, âge et leucocytes), qui a eu de bonnes performances dans l’identification des populations présentant un risque plus élevé de contracter le COVID-19. Cazzaniga et al
15 rapporté que l'éosinopénie absolue dans les analyses de régression logistique binaire était associée à une mortalité à 4 semaines et à des résultats cliniques chez les patients atteints de pneumonie COVID-19.15 Guan et al
16 et Feng et al
17 tous deux ont proposé la LDH comme prédicteur significatif de la mortalité et des effets indésirables dus au COVID-19 avec le modèle XGBoost à arbre simple, qui peut aider à identifier les cas de COVID-19 à haut risque. L'éosinopénie et une LDH élevée ont été identifiées comme facteurs de risque de cas graves de COVID-19 ; cependant, il convient de noter que dans notre étude, ils étaient également associés à la gravité du COVID-19 chez les patients atteints de maladies chroniques des voies respiratoires.
L’association entre le COVID-19 et la fonction pulmonaire suscite de plus en plus d’inquiétudes. Les rapports précédents se sont concentrés sur le suivi respiratoire après une hospitalisation pour COVID-19. Trinkmann et al
18 ont découvert que les patients symptomatiques avaient un volume expiratoire forcé en 1 s, une capacité vitale et un facteur de transfert du poumon pour le monoxyde de carbone significativement inférieurs (TLCO) par rapport aux patients asymptomatiques. Riou et al
19 ont découvert que les patients atteints d'une maladie grave avaient une capacité pulmonaire totale inférieure et un TLCO. Cependant, l’impact de la déficience préexistante de la fonction pulmonaire sur l’issue du COVID-19 n’a pas encore été entièrement élucidé. Actuellement, la littérature connexe est rare, probablement en raison de données limitées sur la fonction pulmonaire et de la fermeture temporaire des laboratoires d’analyse de la fonction pulmonaire pendant la pandémie de COVID-19. Morgenthau et al
20 ont découvert que la mortalité chez les patients atteints de COVID-19 atteints de sarcoïdose était associée à une altération modérée ou sévère de la fonction pulmonaire. Il et al
21 ont rapporté qu'un historique plus long de BPCO augmentait le risque de décès et de conséquences négatives pour les patients atteints de COVID-19, ce qui était cohérent avec les travaux de He.21 Dans notre cohorte, l’altération de la fonction pulmonaire des patients atteints de COVID-19 présentant des maladies chroniques des voies respiratoires sous-jacentes pourrait avoir un impact significatif sur les résultats. Cependant, l’analyse n’a pas pu être réalisée en raison de l’indisponibilité des données, ce qui constitue une limite de cette étude.
Les schémas thérapeutiques antérieurs pourraient contribuer aux résultats des patients atteints de COVID-19 présentant des maladies chroniques des voies respiratoires sous-jacentes. Les corticostéroïdes inhalés (CSI) (avec ou sans β-agoniste à action prolongée) sont appliqués directement sur l'épithélium respiratoire lors de l'intervention dans la BPCO stable et l'asthme afin de réduire l'inflammation des voies respiratoires. Les ICS pourraient diminuer l’expression de l’ACE2 et de la protéase transmembranaire sérine 2 (TMPRSS2) sur les cellules épithéliales des voies respiratoires, les protégeant ainsi de l’invasion du SRAS-CoV-2.22 En outre, la prolifération du coronavirus et la production de cytokines pourraient également être supprimées par l’utilisation des ICS.23 Cependant, la question de savoir si l’utilisation régulière de CSI avant la pandémie a eu un impact sur les résultats de la COVID-19 reste controversée. Floraison et al ont rapporté que les patients asthmatiques âgés de plus de 50 ans pouvaient bénéficier de l'utilisation de CSI dans les 2 semaines suivant leur admission, alors que les patients atteints d'autres maladies pulmonaires chroniques ne le pouvaient pas.24 Schultze et al
25Les travaux de Nie le rôle positif de l'utilisation régulière de CSI dans la protection contre les conséquences graves du COVID-19, à la fois chez les patients asthmatiques et chez les patients atteints de BPCO. Dans notre cohorte, seul un patient atteint de BPCO et deux patients asthmatiques ont déclaré avoir utilisé des CSI à long terme en raison de la difficulté de recueillir les antécédents médicaux au début de la pandémie. Des informations plus détaillées sur les comorbidités, les médicaments antérieurs et de nombreux facteurs de biais doivent être prises en compte pour déterminer les avantages ou les inconvénients des CSI dans le contexte de la COVID-19.
Différents phénotypes de BPCO et d’asthme basés sur une physiopathologie complexe pourraient également être en partie impliqués dans le COVID-19 ; cependant, les hypothèses doivent être clarifiées davantage. Kimura et al
26 ont découvert que les cytokines inflammatoires de type 2 (IL-4, IL-5, IL-13) étaient associées négativement à l'expression d'ACE2 alors qu'elles étaient positivement associées à l'expression de TMPRSS2 dans une étude ex vivo. Ferastraoaru et al
27Les travaux de Kermani ont indiqué qu'un phénotype d'asthme Th2 était un prédicteur d'une réduction de la morbidité et de la mortalité dues au COVID-19, tandis que Kermani et al
28 ont rapporté des résultats de morbidité et de mortalité plus élevés dans l'asthme sévère neutrophile. Un rapport précédent a souligné que l’inflammation éosinophile était également un phénotype courant et stable dans la BPCO et que le nombre d’éosinophiles sanguins pouvait prédire la réponse au traitement par CSI.29 Watson et al n'ont trouvé aucune différence d'expression génique dans ACE2 dans la BPCO à éosinophiles sanguines, ce qui indique en outre que ces patients pourraient ne pas avoir une vulnérabilité différente à l'infection par le SRAS-CoV-2.30 Par conséquent, l’impact des différents types d’inflammation de la BPCO et de l’asthme sur la progression du COVID-19 grave nécessite des recherches plus approfondies.
Notre étude présentait également d’autres limites. Premièrement, en raison de la conception rétrospective de l’étude, l’exactitude de tous les résultats de laboratoire dépendait des dossiers médicaux. Un biais d'observation pourrait également exister dans cette étude en raison de la taille limitée de l'échantillon. Deuxièmement, il pourrait y avoir un biais de sélection dans le modèle de régression multivariée lors de l’analyse des facteurs de risque.