Hintergrund
SARS-CoV-2 wurde erstmals nach der Sequenzierung relevanter klinischer Proben in einer Reihe unbekannter viraler Lungenentzündungsfälle im Dezember 2019 in Wuhan, Provinz Hubei, China, identifiziert. COVID-19, verursacht durch SARS-CoV-2, wurde daraufhin von der WHO aufgrund seiner aggressiven Ausbreitung in großem Maßstab in vielen Ländern zur Pandemie erklärt, was täglich zu Tausenden bestätigten Fällen weltweit führt. Bis zum 15. November 2020 wurden weltweit 53,7 Millionen bestätigte Fälle von COVID-19 und 1,3 Millionen Todesfälle gemeldet, sodass eine frühzeitige Erkennung schwerer Fälle dringend erforderlich ist.1 Klinische Beweise für SARS-CoV-2 deuten auf mehrere Übertragungswege zwischen Menschen hin, wobei Aerosoltröpfchen in der Atemluft zweifellos die Hauptinfektionsquelle darstellen. SARS-CoV-2 kann das Atmungssystem angreifen, indem es an die Zelleintrittsrezeptoren ACE2 auf Atemwegsepithelzellen bindet, und führt bei kritisch kranken Patienten zu Lungenentzündung und Atemversagen.
Chronische Bronchitis, chronisch obstruktive Lungenerkrankung (COPD) und Asthma sind häufige Atemwegserkrankungen mit chronischer Atemwegsentzündung.2–4 Eosinophile, Neutrophile und Makrophagen in der angeborenen Immunantwort nehmen in der Anfangsphase der Entzündung in den Atemwegen und der Lunge deutlich zu. Bei schweren Patienten, die mit SARS-CoV-2 infiziert sind, wurde über Lymphozytopenie berichtet.5 Es wurde auch berichtet, dass die Anzahl zirkulierender Eosinophilen bei Patienten mit COVID-19 verringert ist und mit der Schwere der Erkrankung zusammenhängt.6 Daher können Patienten mit zugrunde liegender COPD, Asthma und chronischer Bronchitis nach einer SARS-CoV-2-Infektion andere Entzündungszustände aufweisen als Patienten ohne chronische Atemwegsentzündung.
In dieser retrospektiven Kohortenstudie überprüften wir die Krankenakten von 59 Patienten mit laborbestätigtem COVID-19 und zugrunde liegender chronischer Atemwegsentzündung und verglichen die demografischen, klinischen und radiologischen Merkmale sowie Laborergebnisse zwischen schweren und nicht schweren Patienten in dieser Kohorte . Mithilfe univariater und multivariater Regressionsmodelle wurden anhand der abnormalen Laborbefunde potenzielle Prädiktoren für die Schwere der Erkrankung identifiziert.
Methoden
Studienpopulation und Datenerfassung
Die Probanden dieser Studie waren Erwachsene mit COVID-19 und zugrunde liegenden chronischen Atemwegserkrankungen (Aufnahmedatum vom 26. Januar bis 3. April 2020) in der chinesisch-französischen New City Branch des Tongji Hospital. In die Fall- bzw. Kontrollgruppe wurden schwere und nicht schwere Patienten einbezogen. COVID-19 wurde gemäß der vorläufigen WHO-Leitlinie diagnostiziert.7 Patienten mit chronischen Atemwegserkrankungen wurden gemäß einer früheren Diagnose diagnostiziert. Alle Patienten wurden durch positive Ergebnisse im Reverse-Transkriptase-PCR-Assay von SARS-CoV-2-RNA in Rachenabstrichproben bestätigt. Die Studie wurde am 15. Juni durchgeführt. Demografische Informationen, klinische Merkmale (einschließlich Krankengeschichte, Symptome, Komorbiditäten, Rauchergeschichte und Allergiegeschichte) und radiologische Ergebnisse jedes Patienten wurden aus dem elektronischen Krankenaktensystem der chinesisch-französischen New City Branch abgerufen des Tongji-Krankenhauses untersucht und von drei unabhängigen Forschern analysiert. Der Schweregrad von COVID-19 wurde gemäß den vom Chinesischen Nationalen Gesundheitskomitee veröffentlichten Richtlinien zur Diagnose und Behandlung von COVID-19 (Version 5–7) eingestuft.
Kriterien für den Schweregrad von COVID-19
Eine schwere COVID-19-Erkrankung wurde diagnostiziert, wenn die Patienten eines der folgenden Kriterien erfüllten: (1) Atemnot mit einer Atemfrequenz von ≥ 30 pro Minute; (2) Sauerstoffsättigung des Pulsoximeters ≤93% im Ruhezustand; und (3) Oxygenierungsindex (arterieller Sauerstoffpartialdruck/eingeatmeter Sauerstoffanteil) ≤300 mm Hg.
Laboruntersuchungen
Medizinische Laborergebnisse, einschließlich Anzahl der Leukozyten, Lymphozyten, Monozyten, Eosinophilen, Basophilen, Blutplättchen, Alaninaminotransferase, Aspartataminotransferase, Serumkreatinkinase, Serumlaktatdehydrogenase (LDH), Blutharnstoffstickstoff, Serumkreatinin, kardiales Troponin I, Konzentrationen von D -Dimer, C-reaktives Protein (CRP), Procalcitonin, Erythrozytensedimentationsrate, Serumferritin, Zytokine (Interleukin (IL) 2R, IL-6, IL-8, IL-10, Tumornekrosefaktor (TNF)-α) und Immun Funktion wurden für jeden Patienten aus den elektronischen Krankenakten erfasst.
statistische Analyse
Alle Daten wurden mit der SPSS Statistics Software (V.26) analysiert. Die Statistiken für kategoriale Variablen wurden als Häufigkeiten und Prozentsätze zusammengefasst und mit χ verglichen2 Test oder exakter Fisher-Test zwischen verschiedenen Gruppen, sofern angemessen. Kontinuierliche Variablen wurden mithilfe des Medians (IQR) beschrieben und mithilfe des Mann-Whitney-U-Tests verglichen. Um die mit der Schwere der Erkrankung verbundenen Risikofaktoren zu untersuchen, wurden univariable und multivariable logistische Regressionsmodelle zur Schätzung des OR und des 95%-KI verwendet. Ein zweiseitiger α von weniger als 0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Demografische Daten und klinische Merkmale von Patienten mit nicht schwerer und schwerer COVID-19-Erkrankung mit chronischen Atemwegserkrankungen
Insgesamt wurden 1888 Patienten aufgenommen. Bei 59 Patienten mit zugrunde liegender chronischer Atemwegsentzündung, darunter COPD (0,951 TP3T), Asthma (0,531 TP3T) und chronische Bronchitis (1,641 TP3T), wurde eine SARS-CoV-2-Infektion bestätigt. Von den Patienten wurden 33 als nicht schwer und 26 als schwer eingestuft. Obwohl COPD bei Patienten mit schwerem COVID-19 häufiger auftrat als bei Patienten mit nicht schwerem COVID-19 (42% vs. 21%), war der Unterschied statistisch nicht signifikant.
Das Durchschnittsalter aller Patienten betrug 71 Jahre (IQR: 57–80) und mehr als die Hälfte (54%) war über 70 Jahre alt. Die Mehrheit (71%) der Patienten war männlich (Tabelle 1). Es gab keinen signifikanten Unterschied in Alter und Geschlecht zwischen nicht schweren und schweren Patienten. Einunddreißig (53%) Patienten hatten neben den drei chronischen Atemwegserkrankungen eine oder mehrere Komorbiditäten, wobei Herz-Kreislauf-Erkrankungen (46%) und Erkrankungen des endokrinen Systems (15%) die häufigsten Komorbiditäten waren. Es gab keine signifikanten Unterschiede im Vorliegen dieser Komorbiditäten zwischen Patienten mit nicht schwerer und schwerer COVID-19-Erkrankung. Die Hälfte der Patienten hatte eine Rauchergeschichte oder war derzeit Raucher.
Demografische und klinische Merkmale von Patienten mit COVID-19 und chronischer Atemwegsentzündung bei Aufnahme
Die häufigsten Symptome waren Fieber (83%), Husten (73%), Müdigkeit (47%) und Atemnot (42%). Dyspnoe trat bei Patienten mit schwerer Erkrankung häufiger auf als bei nicht schweren Patienten (65% vs. 24%, p=0,001) (Tabelle 1).
Laborbefunde von Patienten mit nicht schwerer und schwerer COVID-19-Erkrankung mit chronischen Atemwegserkrankungen
Im Vergleich zu nicht schweren Patienten wiesen schwere Patienten häufiger eine erhöhte Neutrophilenzahl (8,2 × 10⁹/l gegenüber 4,1 × 10⁹/l, p = 0,001) und eine verringerte Lymphozytenzahl (0,6 × 10⁹/l gegenüber 1,1 × 10⁹/l auf) L, p<0,001), Eosinopaenie (<0,02×10⁹/L; 73% vs. 24%, p<0,001), erhöhtes D-Dimer (>1 µg/ml; 88% vs. 42%, p=0,001), erhöhtes LDH (471,0 U /L vs. 230,0 U/L, p<0,001), erhöhter Harnstoffstickstoff im Blut (>9,5 mmol/L; 42% vs. 3%, p<0,001), erhöhtes hypersensitives Troponin I (>34 pg/ml; 48% vs. 7%, p=). 0,001) und erhöhte Entzündungsmarker, einschließlich CRP (126,2 mg/L vs. 19,9 mg/L, p<0,001), Procalcitonin (≥0,05 ng/ml; 96% vs. 43%, p<0,001) und Ferritin (1264,2 mg/L vs. 293,6). mg/L, p=0,004) (Tabelle 2). Bemerkenswert ist, dass zwischen den beiden Gruppen signifikante Unterschiede in der Expression entzündungsbedingter Zytokine, einschließlich IL-6, IL-8 und TNF-α, beobachtet wurden, die bei schweren Patienten dramatisch erhöht waren.
Laborbefunde von Patienten mit COVID-19 und chronischer Atemwegsentzündung bei Aufnahme
Prädiktoren für den Schweregrad von COVID-19 bei Patienten mit chronischen Atemwegserkrankungen
Um die Prädiktoren für den Schweregrad von COVID-19 bei Patienten mit chronischen Atemwegserkrankungen zu identifizieren, haben wir den Zusammenhang zwischen abnormalen Laborbefunden und dem Schweregrad der Erkrankung mit univariaten und multivariaten logistischen Regressionsmodellen analysiert. Der Schweregrad der Erkrankung war in univariaten logistischen Regressionsanalysen signifikant mit allen oben genannten abnormalen Laborbefunden verbunden. In einem multivariaten Regressionsmodell, das Lymphopenie, Eosinopenie, erhöhtes LDH und erhöhtes IL-6 berücksichtigte, ergaben sich Eosinophilenzahlen <0,02×10⁹/L (OR pro Abnahme um eine Einheit, 10,115 (95%-KI 2,158 bis 47,414), p=0,003) und LDH Wert >225 U/L (OR pro Anstieg um eine Einheit, 22.300 (95% CI 2,179 bis 228,247), p=0,009) waren unabhängige Risikofaktoren für die Schwere der Erkrankung (Tisch 3). Unsere Daten deuten darauf hin, dass eine verringerte Eosinophilenzahl und ein erhöhter LDH-Spiegel Ärzten dabei helfen können, schweres COVID-19 bei Patienten mit chronischen Atemwegserkrankungen zu erkennen.
Prädiktoren für den Schweregrad von COVID-19 bei Patienten mit chronischen Atemwegserkrankungen
Bei nicht schweren Patienten neigen die Eosinophilenzahlen und die LDH-Werte dazu, im Laufe der Zeit in den Normalbereich zurückzukehren
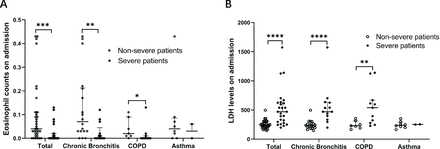
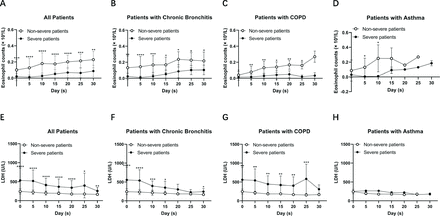
Wir analysierten außerdem die Eosinophilenzahlen und LDH-Werte bei Patienten mit nicht schwerem und schwerem COVID-19 mit chronischer Bronchitis, COPD bzw. Asthma. Wir fanden heraus, dass es einen signifikanten Unterschied in der Eosinophilenzahl und dem LDH-Spiegel zwischen schweren und nicht schweren Patienten mit chronischer Bronchitis und COPD gab, nicht jedoch bei Patienten mit Asthma (Abbildung 1). Um die dynamischen Veränderungen der Eosinophilenzahlen und LDH-Werte im Laufe der Zeit zu beobachten, haben wir die Eosinophilenzahlen und LDH-Werte am 5., 10., 15., 20., 25. und 30. Tag nach der Aufnahme erfasst. Wir fanden heraus, dass die Eosinophilenzahl im Laufe der Zeit sowohl bei schweren als auch bei nicht schweren Patienten zunahm. Unterdessen nahm LDH im Laufe der Zeit ab (Figur 2). Schwere Patienten zeigten eine langsamere Genesungsrate als nicht schwere Patienten. Bemerkenswert ist, dass sich sowohl die Eosinophilenzahl als auch der LDH-Spiegel bei Patienten mit schwerer COPD langsamer erholten als bei Patienten mit schwerer Krankheit und chronischer Bronchitis. Unsere Daten deuten darauf hin, dass die Eosinophilenzahl und die LDH-Werte mit der Genesung der Krankheit sowohl bei schweren als auch bei nicht schweren Patienten tendenziell in den Normalbereich zurückkehren, was auf eine gute therapeutische Wirkung bei Patienten mit chronischen Atemwegserkrankungen bei der Behandlung von COVID-19 hinweist.
Klinische Merkmale von Eosinophilen und LDH bei Patienten mit COVID-19 mit chronischer Atemwegsentzündung. (A) Eosinophile zählen in verschiedenen Untergruppen. Bei Patienten mit schwerer COVID-19-Erkrankung mit chronischer Bronchitis und COPD war die Eosinophilenzahl signifikant verringert. (B) LDH-Spiegel in verschiedenen Untergruppen. Bei Patienten mit schwerer COVID-19-Erkrankung mit chronischer Bronchitis und COPD waren die LDH-Spiegel signifikant erniedrigt. Werte für nicht schwere und schwere Patienten werden durch offene bzw. geschlossene Kreise dargestellt. Es wurde der Mann-Whitney-U-Test verwendet. *P<0,05, **P<0,01, ***P<0,001, ****P<0,0001. COPD, chronisch obstruktive Lungenerkrankung; LDH, Laktatdehydrogenase.
Dynamische Veränderungen der Eosinophilenzahl und des LDH-Spiegels bei Patienten mit COVID-19 und chronischen Atemwegserkrankungen. (A–D) Die Eosinophilenzahlen stiegen im Laufe der Zeit bei nicht schweren und schweren Patienten mit COVID-19 mit chronischer Bronchitis (n=31), COPD (n=18) und Asthma (n=10). (E–H) Die LDH-Spiegel sanken im Laufe der Zeit bei nicht schweren und schweren Patienten mit COVID-19 mit chronischer Bronchitis (n=31), COPD (n=18) und Asthma (n=10). Werte für nicht schwere und schwere Patienten werden durch offene bzw. geschlossene Kreise dargestellt. Es wurde der Mann-Whitney-U-Test verwendet. *P<0,05, **P<0,01, ***P<0,001, ****P<0,0001, verglichen mit den Eosinophilenzahlen oder LDH-Werten zwischen schweren und nicht schweren Patienten. COPD, chronisch obstruktive Lungenerkrankung; LDH, Laktatdehydrogenase.
Wir führten außerdem eine multivariate Analyse der Mortalität bei Patienten mit COVID-19 mit chronischer Atemwegsentzündung unter Verwendung der oben genannten vier Variablen durch und stellten fest, dass die Eosinophilenzahl <0,02×10⁹/L (OR pro Abnahme um eine Einheit, 18.000 (95% CI 1,929 bis 167,986)) beträgt. p=0,011) war der einzige unabhängige Risikofaktor für Mortalität (Online-Ergänzungstabelle 1). Darüber hinaus zeigten die Kaplan-Meier-Überlebenskurven, dass Patienten mit COVID-19 mit Eosinopenie oder erhöhtem LDH eine schlechtere Überlebenswahrscheinlichkeit hatten (p<0,05) (Online-Ergänzungsabbildung 1). Dies legt nahe, dass Eosinopaenie und erhöhtes LDH auch potenzielle Prädiktoren für die Mortalität bei Patienten mit COVID-19 und zugrunde liegenden chronischen Atemwegserkrankungen sind.
Ergänzendes Material
Diskussion
In dieser retrospektiven Kohortenstudie fanden wir heraus, dass Eosinophilenzahlen von weniger als 0,02×10⁹/L und LDH-Werte von mehr als 225 U/L bei der Aufnahme mit dem Schweregrad von COVID-19 bei Patienten mit zugrunde liegender chronischer Bronchitis, COPD und Asthma verbunden waren. Darüber hinaus tendieren die Eosinophilenzahlen und die LDH-Werte dazu, nach der Behandlung bei schweren und nicht schweren Patienten in den Normalbereich zurückzukehren, was darauf hindeutet, dass sie als Indikatoren für das Fortschreiten der Krankheit und die Wirksamkeit der Behandlung fungieren.
Zirkulierende und im Gewebe vorkommende Eosinophile werden mit einer Vielzahl von Krankheiten in Verbindung gebracht, bei denen Eosinophile am pathologischen Prozess beteiligt sind und eine starke proinflammatorische Rolle spielen, wie z. B. COPD, Asthma und chronische Bronchitis. Angesichts der erhöhten Eosinophilenzahl bei Patienten mit chronischer Atemwegsentzündung wurden COPD, Asthma und chronische Bronchitis bisher nicht als Hauptrisikofaktoren für die Schwere von SARS-CoV-2-Infektionen gemeldet. Zhang et al
8 berichteten, dass in einer Kohorte von 140 hospitalisierten Patienten mit COVID-19 keiner an Asthma oder anderen komorbiden atopischen Erkrankungen litt und nur zwei Patienten an COPD (1,4%) litten, von denen mehr als die Hälfte (53%) am Tag der Krankenhauseinweisung an Eosinopenie litt. Ebenso Du et al
9 analysierte die klinischen Merkmale von 85 tödlichen Fällen von COVID-19 und stellte fest, dass 81% der Patienten bei der Aufnahme sehr niedrige Eosinophilenzahlen aufwiesen. In unserer Kohorte mit 1888 Patienten hatten 31 Patienten chronische Bronchitis (1,641 TP3T), 18 Patienten hatten COPD (0,951 TP3T) und nur 10 Patienten hatten Asthma (0,531 TP3T). Unterdessen trat Eosinopaenie häufiger bei Patienten mit kritischem Krankheitsverlauf auf, was darauf hindeutet, dass die Beseitigung der Eosinopaenie ein möglicher Weg zur Verbesserung des klinischen Status sein könnte.10 In unserer Studie zeigte eine geringere Anzahl an Eosinophilen eine schlechtere Überlebenswahrscheinlichkeit, und die Anzahl der Eosinophilen sank bei Patienten mit schwerer COVID-19-Erkrankung mit chronischer Bronchitis und COPD signifikant. Bei Patienten mit Asthma wurde kein signifikanter Unterschied beobachtet, was teilweise auf die begrenzte Stichprobengröße zurückzuführen ist. Darüber hinaus könnte die drastisch erhöhte Eosinophilenzahl in den Atemwegen der meisten Patienten mit chronischem Asthma nach einer Bronchoprovokation eine weitere, wichtigere Ursache sein. Wir untersuchten weiter die dynamischen Veränderungen der Eosinophilenzahlen bei Patienten mit chronischen Atemwegserkrankungen im Verlauf von COVID-19 und stellten fest, dass die Eosinophilenzahlen im Laufe der Zeit allmählich anstiegen und sowohl bei schweren als auch bei nicht schweren Patienten in den Normalbereich zurückkehrten, was möglich sein könnte Indikator für die Wirksamkeit der Behandlung. Es bleibt unklar, wie Eosinopaenie bei COVID-19 auftritt, aber der wahrscheinlichste Grund könnte in der Abschwächung der antiviralen Reaktion liegen, da die antivirale Reaktion von Th1 (Typ-1-T-Helfer) bei Patienten mit chronischer Atemwegsentzündung gehemmt war.
Es wird seit langem berichtet, dass LDH mit COPD, Asthma und chronischer Bronchitis in Zusammenhang steht und als potenzieller Marker für chronische Atemwegsentzündungen identifiziert wird.11 12 Mittlerweile wurde in zahlreichen Studien über erhöhte LDH-Werte bei COVID-19 berichtet, was ein Risikofaktor für die Sterblichkeit sein könnte. Zheng et al
13 führten eine systematische Literaturrecherche und Metaanalyse mit vier Studien durch und stellten fest, dass LDH bei Patienten mit schwerem Krankheitsverlauf statistisch signifikant höher war als bei Patienten mit nicht schwerem Krankheitsverlauf. In schweren Fällen erhöhtes LDH deutete auf eine diffuse Lungenschädigung und Gewebeschädigung hin; Daher stellten wir die Hypothese auf, dass LDH ein weiterer Prädiktor für die Verschlimmerung chronischer Atemwegsentzündungen bei COVID-19 sein könnte. Die Kaplan-Meier-Überlebensanalyse deutete auf die Gefahr erhöhter LDH-Werte hin. Ähnlich wie Eosinophile zeigte LDH bei Patienten mit schwerer COVID-19-Erkrankung mit chronischer Bronchitis und COPD erhöhte Werte und nahm im Laufe der Zeit bei Patienten mit schwerer und nicht schwerer COVID-19-Erkrankung allmählich ab.
Mehrere Untersuchungen haben die wichtige Rolle von Eosinopenie und erhöhtem LDH bei der Erleichterung der Diagnose und Prognose einer schweren COVID-19-Erkrankung hervorgehoben. Ma et al
14 schloss Eosinopaenie ein, um den COVID-19-REAL-Score (radiologisches Bild, Eosinophile, Alter und Leukozyten) einzuführen, der eine gute Leistung bei der Identifizierung von Bevölkerungsgruppen mit einem höheren Risiko für eine Ansteckung mit COVID-19 erbrachte. Cazzaniga et al
15 berichteten, dass absolute Eosinopaenie in den binären logistischen Regressionsanalysen mit der 4-Wochen-Mortalität und den klinischen Ergebnissen bei Patienten mit COVID-19-Pneumonie verbunden war.15 Guan et al
16 und Feng et al
17 Beide schlugen mit dem Simple-Tree-XGBoost-Modell LDH als signifikanten Prädiktor für die COVID-19-Mortalität und unerwünschte Folgen vor, was bei der Identifizierung von Hochrisiko-COVID-19-Fällen helfen könnte. Eosinopenie und erhöhtes LDH wurden als Risikofaktoren für schwere COVID-19-Fälle identifiziert; Es ist jedoch bemerkenswert, dass sie in unserer Studie auch mit der Schwere von COVID-19 bei Patienten mit chronischen Atemwegserkrankungen assoziiert waren.
Es bestehen wachsende Bedenken hinsichtlich des Zusammenhangs zwischen COVID-19 und der Lungenfunktion. Frühere Berichte konzentrierten sich auf die Nachsorge der Atemwege nach einem Krankenhausaufenthalt wegen COVID-19. Trinkmann et al
18 fanden heraus, dass symptomatische Patienten ein signifikant geringeres forciertes Exspirationsvolumen in 1 s, eine geringere Vitalkapazität und einen geringeren Übertragungsfaktor der Lunge für Kohlenmonoxid aufwiesen (TLCO) im Vergleich zu asymptomatischen Patienten. Riou et al
19 fanden heraus, dass Patienten mit kritischer Erkrankung eine geringere Gesamtlungenkapazität und T aufwiesenLCO. Allerdings ist noch nicht vollständig geklärt, wie sich die bereits bestehende Beeinträchtigung der Lungenfunktion auf den Verlauf von COVID-19 auswirkte. Derzeit ist die entsprechende Literatur rar, möglicherweise aufgrund begrenzter Daten zur Lungenfunktion und der vorübergehenden Schließung von Laboren für Lungenfunktionstests während der COVID-19-Pandemie. Morgenthau et al
20 fanden heraus, dass die Mortalität bei Patienten mit COVID-19 und Sarkoidose mit einer mittelschweren oder schweren Beeinträchtigung der Lungenfunktion verbunden war. Er et al
21 berichteten, dass eine längere COPD-Vorgeschichte das Sterberisiko und negative Folgen von Patienten mit COVID-19 erhöhte, was mit Hes Arbeit übereinstimmte.21 In unserer Kohorte könnte die beeinträchtigte Lungenfunktion von Patienten mit COVID-19 und zugrunde liegenden chronischen Atemwegserkrankungen einen erheblichen Einfluss auf das Ergebnis haben. Allerdings konnte die Analyse aufgrund nicht verfügbarer Daten nicht durchgeführt werden, was eine Einschränkung dieser Studie darstellte.
Bisherige Behandlungsschemata könnten zum Ergebnis von Patienten mit COVID-19 mit zugrunde liegenden chronischen Atemwegserkrankungen beitragen. Inhalative Kortikosteroide (ICS) (mit oder ohne langwirksamen β-Agonisten) werden bei der Intervention bei stabiler COPD und Asthma direkt auf das Atemwegsepithel aufgetragen, um Atemwegsentzündungen zu reduzieren. ICS könnte die Expression von ACE2 und Transmembranprotease Serin 2 (TMPRSS2) auf Atemwegsepithelzellen verringern und diese anschließend vor dem Eindringen von SARS-CoV-2 schützen.22 Darüber hinaus könnte durch den Einsatz von ICS auch die Ausbreitung des Coronavirus und die Zytokinproduktion unterdrückt werden.23 Allerdings bleibt umstritten, ob der Einsatz regelmäßiger ICS vor der Pandemie einen Einfluss auf die COVID-19-Ergebnisse hatte. blühen et al berichteten, dass Patienten mit Asthma, die älter als 50 Jahre sind, innerhalb von 2 Wochen nach der Aufnahme von der Verwendung von ICS profitieren könnten, während dies bei Patienten mit anderen chronischen Lungenerkrankungen nicht der Fall wäre.24 Schultze et al
25In seiner Arbeit wurde die positive Rolle des regelmäßigen ICS-Einsatzes beim Schutz vor schweren Folgen von COVID-19 sowohl bei Patienten mit Asthma als auch bei Patienten mit COPD bestritten. In unserer Kohorte gaben nur ein Patient mit COPD und zwei Patienten mit Asthma an, ICS über einen längeren Zeitraum angewendet zu haben, da es zu Beginn der Pandemie schwierig war, Krankengeschichten zu erheben. Weitere detaillierte Informationen zu Komorbiditäten, vorheriger Medikation und vielen Bias-Faktoren sollten berücksichtigt werden, um den Nutzen oder Schaden von ICS bei COVID-19 herauszufinden.
Verschiedene Phänotypen von COPD und Asthma, die auf der komplexen Pathophysiologie basieren, könnten teilweise auch an COVID-19 beteiligt sein; Allerdings müssen die Hypothesen noch weiter geklärt werden. Kimura et al
26 fanden in einer Ex-vivo-Studie heraus, dass entzündliche Zytokine vom Typ 2 (IL-4, IL-5, IL-13) negativ mit der ACE2-Expression assoziiert waren, während sie positiv mit der TMPRSS2-Expression assoziiert waren. Ferastraoaru et al
27Die Arbeit von Kermani et al
28 berichteten über ein höheres Morbiditäts- und Mortalitätsergebnis bei neutrophilem schwerem Asthma. In einem früheren Bericht wurde hervorgehoben, dass eosinophile Entzündungen auch ein häufiger und stabiler Phänotyp bei COPD seien und dass die Anzahl der Eosinophilen im Blut das Ansprechen auf die ICS-Behandlung vorhersagen könne.29 Watson et al fanden keine Unterschiede in der Genexpression von ACE2 bei eosinophiler COPD im Blut, was ein weiterer Hinweis darauf ist, dass diese Patienten möglicherweise nicht anders anfällig für eine SARS-CoV-2-Infektion sind.30 Daher muss weiter untersucht werden, wie sich verschiedene Entzündungsarten von COPD und Asthma auf den Verlauf einer schweren COVID-19-Erkrankung auswirken könnten.
Unsere Studie hatte auch einige andere Einschränkungen. Erstens hing die Genauigkeit aller Laborergebnisse aufgrund des retrospektiven Studiendesigns von den Krankenakten ab. Aufgrund der begrenzten Stichprobengröße könnte in dieser Studie auch ein Beobachtungsfehler vorliegen. Zweitens könnte es bei der Analyse der Risikofaktoren zu einem Selektionsbias im multivariaten Regressionsmodell kommen.